
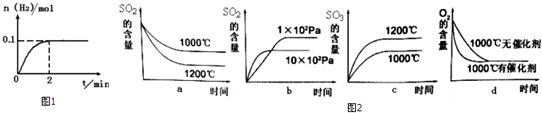
分析 (1)a.硫酸常温下,不易分解.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;根据反应方程式写平衡表达式;利用浓度对化学平衡的影响来分析HI的平衡浓度、达到平衡的时间、平衡时H2的体积分数,但温度不变,平衡常数不变;
(3)升高温度,加快反应速率到达平衡的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低;增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,二氧化硫的含量减少;使用催化剂,能加快反应速率,缩短达到平衡的时间,但不影响平衡,据此结合图象判断;500℃与催化剂的活性、反应速率有关;
(4)二氧化硫和氨水反应可生成亚硫酸铵或亚硫酸氢铵,计算出ag亚硫酸铵或亚硫酸氢铵放出二氧化硫消耗硫酸的体积.
解答 解:(1)a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,还原性比HI强,故b正确;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故答案为:bc;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为$\frac{0.1mol}{2L}$=0.05mol/L,用氢气表示的化学反应速率为$\frac{0.05mol/L}{2min}$=0.025mol/(L.min),
由反应中的化学计量数可知v(HI)=0.025mol/(L.min)×2=0.05mol/(L.min);根据方程式可写出平衡常数表达式为:K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$;
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,
则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.05mol•L-1•min-1;$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$;b;
(3)升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,二氧化硫的含量升高,故a错误,b正确;增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,二氧化硫的含量减少,图象与实际不符合,故c错误;使用催化剂,能加快反应速率,缩短达到平衡的时间,但不影响平衡,故d正确;
实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是催化剂的活性较高、加快反应速率,
故选:bd;催化剂的活性较高、加快反应速率;
(4)设ag亚硫酸铵完全转化为二氧化硫消耗硫酸的体积为x,设ag亚硫酸氢铵完全转化为二氧化硫消耗硫酸的体积为y:
(NH4)2SO3 ~H2SO4
116 1mol
ag 18.4x
$\frac{116g}{ag}$=$\frac{1mol}{18.4x}$,解得x=$\frac{a}{116×18.4}$L
2NH4HSO3 ~H2SO4
198g 1mol
ag 18.4y
$\frac{198g}{a}$=$\frac{1mol}{18.4y}$,解得y=$\frac{a}{198×18.4}$L,
因氨气和二氧化硫反应可能生成亚硫酸铵或亚硫酸氢铵或为亚硫酸铵和亚硫酸酸氢铵的混合物,故消耗硫酸的范围为:$\frac{a}{116×18.4}$L~$\frac{a}{198×18.4}$L,
故答案为:$\frac{a}{116×18.4}$L~$\frac{a}{198×18.4}$L.
点评 本题主要考查了反应方程式的分析及计算,反应平衡图象,题目难度中等.对于图象,要看清图象的含义、拐点、平衡点,结合平衡移动规律进行判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
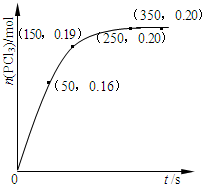 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操 作 | 溶液浓度 |
| 砝码放在左盘、NaOH固体放右盘进行称量(1g以下使用游码) | ① |
| 转移溶液时有少量液体洒落到容器外 | ② |
| 定容时俯视刻度线 | ③ |
| 摇匀后观察到液面低于刻度线,立即补充水到凹液面与刻度线水平相切 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
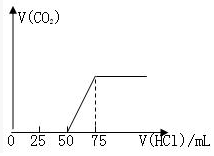 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com