
| |||||||||||||||||||
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
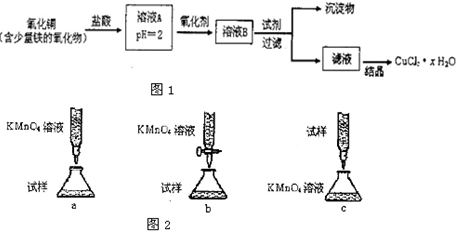
| 80m-135n2 |
| 18n2 |
| 80m-135n2 |
| 18n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
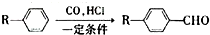
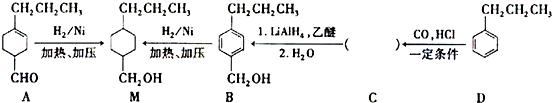
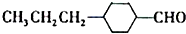 和
和查看答案和解析>>
科目:高中化学 来源: 题型:
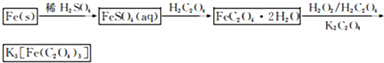
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三3月第一次联考化学试卷(解析版) 题型:实验题
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下。请回答下列问题:

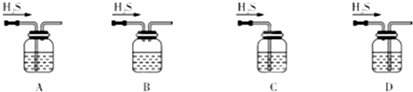
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是??????????????? (填序号)。

(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是?????????????????? ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是??????????????????????????? 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是????????????????????????????????????????????????????????????????? 。
(4)C2O 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式???????????????????????????????????????????? 。
②下列滴定操作中使滴定结果偏高的是????????????? (填序号)。
A.滴定管用蒸馏水洗涤后,立即装入标准液
B.锥形瓶在装待测液前未用待测液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数
③取产物10.0 g配成100 mL溶液,从中取出20 mL于锥形瓶中,用浓度为0.1mol·L-l的酸性KMnO4溶液滴定,达到滴定终点时消耗酸性KMnO4溶液24.00mL,则产物中K3 [Fe(C2O4)3]·3H2O的质量分数为???? [已知摩尔质量M{ K3[Fe(C2O4)3]·3H2O)=491 g·mol-l]。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省宜春市高三上学期第五次月考理综化学试卷(解析版) 题型:实验题
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下,请回下列问题:

(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。

(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤③需要在干燥器中进行的原因是 ;
步骤⑤的目的是 。
(4) 可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 ;
②下列滴定操作中使滴定结果偏高的是 ;
A.滴定管用蒸馏水洗涤后,立即装入标准液
B.锥形瓶在装待测液前未用待测液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数
③取产物10.0g配成100mL溶液,从中取出20mL于锥形瓶中,用浓度为0.1mol·L-1酸性KMnO4溶液滴定,达到滴定终点时酸性KMnO4溶液消耗24mL,计算产物中K3[Fe(C2O4)3]·3H2O的质量分数 。[已知摩尔质量M(K3[Fe(C2O4)3]·3H2O)=491g·mol-1]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com