
 .
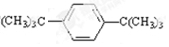
. 分析 液态烃A的分子式为C14H22,符合CnH2n-6,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,应为苯的同系物,烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则结构对称、烃基、苯环各含有1个等效H原子,以此解答该题.
解答 解:液态烃A的分子式为C14H22,符合CnH2n-6,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,应为苯的同系物,烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则结构对称、烃基、苯环各含有1个等效H原子,结构简式应为 ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物结构的判断,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石跟盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与盐酸的反应OH-+H+═H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
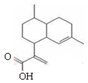
| A. | 青蒿素分子式为:C15H20O2 | |
| B. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| C. | 在一定条件,可与乙醇发生酯化反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
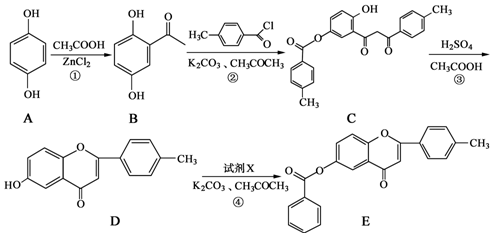
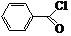 .
.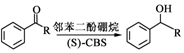 .
.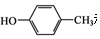 和CH3COOH为原料制备
和CH3COOH为原料制备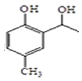 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
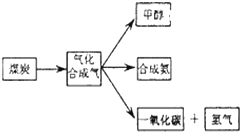
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com