
| A. | 质量a g的C2H4和C3H6的混合物中共用电子对数目为$\frac{3a{N}_{A}}{14}$ | |
| B. | 常温下,0.1 mol•L-1的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 7.8g过氧化钠固体中阴、阳离子总数为0.4NA |
分析 A.在乙烯、丙烯和环丙烷分子中,平均每个碳原子形成一个碳碳键、每个氢原子形成一个碳氢键;
B.溶液体积不知不能计算微粒数;
C.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子;
D.7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有0.3mol离子.
解答 解:A.ag混合物中含有最简式CH2的物质的量为:$\frac{ag}{14g/mol}$=$\frac{a}{14}$mol,ag混合物中含有$\frac{a}{14}$molC原子、$\frac{a}{7}$molH原子,共用电子对数目为$\frac{3a{N}_{A}}{14}$,故A正确;
B.常温下,0.1 mol•L-1的NaOH溶液中含有OH一的浓度为0.1mol/L,溶液体积不知不能计算氢氧根离子数,故B错误;
C.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故C错误;
D.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol阳离子钠离子、0.1mol阴离子过氧根离子,总共含有0.3mol阴阳离子,阴、阳离子总数为0.3NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,掌握基础是解题关键.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③① | C. | ③②① | D. | ③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图装置,可快速制取氨气 | |
| B. |  利用图装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. |  利用图装置,可制取乙酸乙酯 | |
| D. |  利用图装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氨通入盐酸中:NH3+H+═NH4+ | |
| B. | 在NaOH溶液中滴入几滴NH4CI溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜粉放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,其质量逐渐减少 | |
| B. | 电子由铜片经导线流向锌片 | |
| C. | H+在铜片表面被还原,产生气泡 | |
| D. | 锌片上发生氧化还原,铜片上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 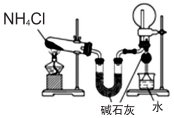 用于实验室制氨气并收集干燥的氨气 | |
| B. |  用于除去CO2中含有的少量HC1 | |
| C. | 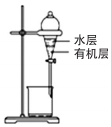 用于提取I2的CCl4溶液中的I2 | |
| D. | 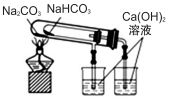 装置用于验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的氢离子浓度为10-10 mol•L-1 | |
| B. | 溶液中c(H+)•c(OH-)=1×10-14 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 溶液中c(NH3•H2O)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
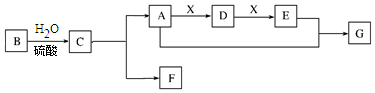
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com