
分析 (1)①食盐有咸味;③青霉素是抗生素;④鸡蛋富含蛋白质;⑤西红柿富含维生素;②食用油富含油脂;⑥塑料是合成材料;
(2)Ⅰ.元素的化合价升高,作还原剂,元素的化合价降低,作氧化剂;
Ⅱ.维生素C,可使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,作氧化剂;
Ⅲ.铁与盐酸反应生成氯化亚铁和氢气.
解答 解:(1)①食盐有咸味,可做调味剂;②食用油富含油脂;③青霉素是抗生素;④鸡蛋富含蛋白质;⑤西红柿富含维生素⑥塑料是人工合成材料,故答案为:①;③;④;⑤;②;⑥;
(2)Ⅰ.Fe2+→Fe3+的转化时,元素的化合价升高,作还原剂;Fe3+→Fe2+转化时,元素的化合价降低,作氧化剂,
故答案为:还原剂;氧化剂;
Ⅱ.维生素C,可使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,作氧化剂,则维生素C具有还原性,作还原剂,故答案为:还原剂;
Ⅲ.铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐的离子方程式为:Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
点评 本题考查营养素以及氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w?m-n?}{n}$mol | C. | $\frac{w}{m}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
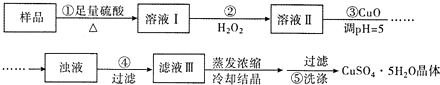
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
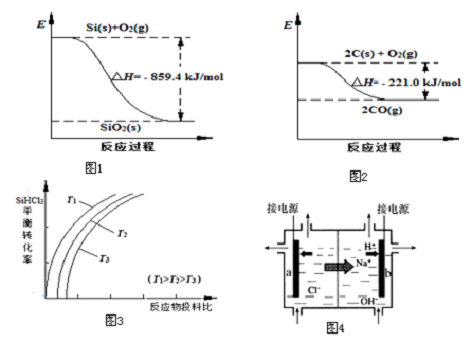
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称取NaOH固体 | B. | 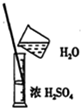 稀释浓硫酸 | ||
| C. | 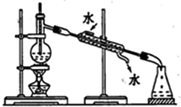 分离乙醇和水混合物 | D. |  电解炼制铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com