
分析 (1)有机物的名称书写要规范;含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
(2)①Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体;
②Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性;相同浓度的Na2CO3和NaHCO3组成的混合溶液中,HCO3-水解程度小于CO32-,钠离子不水解,但其水解程度都较小,据此判断离子浓度大小;
(3)乙醇在负极发生氧化反应生成碳酸根离子和水;
(4)根据盖斯定律,将所给的反应通过加减乘除等变形得所要求的目标反应,反应热做相应的变化即可;
解答 解:(1)2,2,3,3,-四甲基-1-戊醇即最长碳链含有5个碳,在2号碳上含有两个甲基,在3号碳上含两个甲基,故依据命名正确结构简式是:HOCH2C(CH3)2C(CH3)2CH2CH3,
故答案为:HOCH2C(CH3)2C(CH3)2CH2CH3;
(2)①Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体,离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
②Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,碳酸钠溶液中碳酸根离子水解溶液显碱性,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:CO32-+H2O?HCO3-+OH-,c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)乙醇在负极发生氧化反应生成碳酸根离子和水,离子方程式为:C2H6O+16OH--12e-=2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O;
(4)(4)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242.0kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
根据盖斯定律,将①-②-③可得:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5 kJ/mol;
点评 本题综合考查了原电池的电极反应、离子方程式的书写和盐类的水解等以及盖斯定律、有机物命名方法,注意盐类水解实质理解和离子浓度大小比较,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 变化 | △H | △S | 方向性 | |
| A | H2O(l)→H2O(g) | >0 | <0 | 非自发 |
| B | 2NO2(g)?N2O4(g) | <0 | <0 | 自发 |
| C | 2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+(aq) | >0 | >0 | 自发 |
| D | NH4Cl(s)=NH3(g)+HCl(g) | <0 | >0 | 非自发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
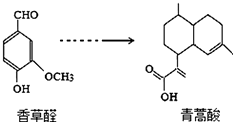
| A. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| B. | 两种物质各1mol分别和氢气反应,最多消耗氢气4mol和3mol | |
| C. | 用FeCl3溶液可鉴别化合物香草醛和青蒿酸 | |
| D. | 青蒿酸分子中含有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )
分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )| A. | 4,5,3 | B. | 4,6,3 | C. | 6,3,4 | D. | 4,4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com