


 ��
�� ��
�� �ǻ�����B��һ��ͬ���칹�壬��1H�˴Ź�������֤���û���������2����ڲ�ͬ�Ļ�ѧ������
�ǻ�����B��һ��ͬ���칹�壬��1H�˴Ź�������֤���û���������2����ڲ�ͬ�Ļ�ѧ������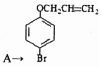 ���л���Ӧ����ȡ����Ӧ��
���л���Ӧ����ȡ����Ӧ�� ��
��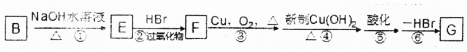
 ��
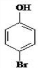
�� ���� ����A��������Ľṹ��ʽ�ɿ������Ӻ��巴Ӧʱ����ԭ�����ǻ��Ķ�λ�ϣ���A�Ľṹ��ʽΪ ��������֪��Ϣ�ٿ�֪C�Ľṹ��ʽ��
��������֪��Ϣ�ٿ�֪C�Ľṹ��ʽ�� ������Ϣ�ڿ�֪D�Ľṹ��ʽ��
������Ϣ�ڿ�֪D�Ľṹ��ʽ��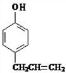 ��
��
��5����B�Ľṹ��ʽ��CH2=CHCH2Br��B����ˮ�ⷴӦ����EΪCH2=CHCH2OH��E��HBr�����ӳɷ�Ӧ����F����F��BrCH2CH2CH2OH����CH3CH��Br��CH2OH��F��������BrCH2CH2CHO��CH3CH��Br��CHO���������������ữ����BrCH2CH2COOH��CH3CH��Br��COOH�����ͨ����ȥ��Ӧ����G����G�ṹ��ʽ��CH2=CHCOOH����Ϊ�������ǻ���ͬʱҲ������̼̼˫������Ϊ�˱���̼̼˫���������÷�Ӧ�ں͢ޣ�G��״���Ӧ���ɵ���H����H�ṹ��ʽ��CH2=CHCOOCH3�������к���̼̼˫�����ɷ����Ӿ۷�Ӧ���ɸ߾��
��� �⣺����A��������Ľṹ��ʽ�ɿ������Ӻ��巴Ӧʱ����ԭ�����ǻ��Ķ�λ�ϣ���A�Ľṹ��ʽΪ ��������֪��Ϣ�ٿ�֪C�Ľṹ��ʽ��
��������֪��Ϣ�ٿ�֪C�Ľṹ��ʽ�� ������Ϣ�ڿ�֪D�Ľṹ��ʽ��
������Ϣ�ڿ�֪D�Ľṹ��ʽ�� ��
��
��1��������������֪��A�Ľṹ��ʽΪ ��C�Ľṹ��ʽΪ
��C�Ľṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��2��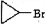 �ǻ�����B��һ��ͬ���칹�壬�ú˴Ź���������֤���û���������2����ڲ�ͬ�Ļ�ѧ�������ʴ�Ϊ��2��
�ǻ�����B��һ��ͬ���칹�壬�ú˴Ź���������֤���û���������2����ڲ�ͬ�Ļ�ѧ�������ʴ�Ϊ��2��
��3�� ת����A���ǻ���Hԭ�ӱ�ȡ��������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
ת����A���ǻ���Hԭ�ӱ�ȡ��������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
��4��������D�� ����ͬ���칹�������������������FeCl3��Һ����ɫ��˵�����з��ǻ����ڱ�����������ȡ�������ұ����ϵ�һ�ȴ��������֣�������ͬ��ȡ�������ڶ�λ������������ͬ���칹���У�
����ͬ���칹�������������������FeCl3��Һ����ɫ��˵�����з��ǻ����ڱ�����������ȡ�������ұ����ϵ�һ�ȴ��������֣�������ͬ��ȡ�������ڶ�λ������������ͬ���칹���У� ��
��
�ʴ�Ϊ�� ��
��
��5����B�Ľṹ��ʽ��CH2=CHCH2Br��B����ˮ�ⷴӦ����EΪCH2=CHCH2OH��E��HBr�����ӳɷ�Ӧ����F����F��BrCH2CH2CH2OH����CH3CH��Br��CH2OH��F��������BrCH2CH2CHO��CH3CH��Br��CHO���������������ữ����BrCH2CH2COOH��CH3CH��Br��COOH�����ͨ����ȥ��Ӧ����G����G�ṹ��ʽ��CH2=CHCOOH����Ϊ�������ǻ���ͬʱҲ������̼̼˫������Ϊ�˱���̼̼˫���������÷�Ӧ�ں͢ޣ�G��״���Ӧ���ɵ���H����H�ṹ��ʽ��CH2=CHCOOCH3�������к���̼̼˫�����ɷ����Ӿ۷�Ӧ���ɸ߾����
�����÷�Ӧ�ڡ���Ŀ���ǣ�����̼̼˫�����ʴ�Ϊ������̼̼˫����
�ڷ�Ӧ�۵Ļ�ѧ��Ӧ����ʽΪ��2HOCH2CH2CH2Br+O2$��_{��}^{Cu}$2BrCH2CH2CHO+2H2O��
�ʴ�Ϊ��2HOCH2CH2CH2Br+O2$��_{��}^{Cu}$2BrCH2CH2CHO+2H2O��
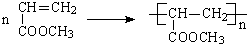
��H�ṹ��ʽ��CH2=CHCOOCH3�������к���̼̼˫�����ɷ����Ӿ۷�Ӧ���ɸ߾��H�ۺϵĻ�ѧ��Ӧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л����ƶϣ���Ҫѧ���Ը������Ϣ�������ã��ϺõĿ���ѧ����ѧ��������������������ע������л���ṹ�뷴Ӧ�����ƶϣ���ȷ�ƶ������ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B�� | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C�� | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D�� | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 900��ʱ���÷�Ӧ��ƽ�ⳣ��K��1 | |
| B�� | 850��ʱ����x=5������ʼʱ��Ӧ���淴Ӧ������� | |
| C�� | 850��ʱ����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ����0��x��3 | |
| D�� | 850��ʱ����֪x��3��������x������H2��ת����һ��ʼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
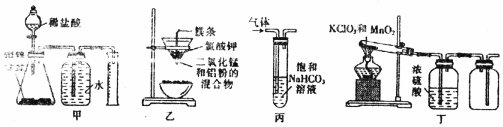
| A�� | װ�üף��ⶨ�Ͻ���Zn�ĺ��� | B�� | װ���ң���ȡ������ | ||
| C�� | װ�ñ���ϴ����ȥSO2�е�CO2 | D�� | װ�ö���ʵ������ȡO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 3O2��g��=2O3��g����H=+242.4kJ•mol-1 | |
| B�� | �����ȳ����ȶ��������г������ױ��ƻ� | |
| C�� | ����l mol O2��g���еĹ��ۼ����յ��������γ�1 molCO2��g���еĹ��ۼ��ų��������� | |
| D�� | ��ͬ���ʵ����������ȳ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
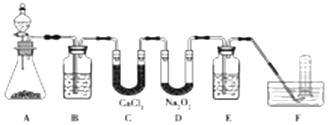
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com