
����Ŀ���������ڲ�ͬ�ܼ�����NaOH������ͬ���͵ķ�Ӧ�����ɲ�ͬ�ķ�Ӧ���
ijͬѧ��������������ʣ�����ͼʵ��װ��(����̨���ƾ�����)��֤ȡ����Ӧ����ȥ��Ӧ�IJ������һ�����̽����
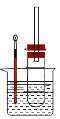
ʵ����������Թ��м���5 mL 1 mol/L NaOH��Һ��5 mL �����飬��
ʵ�����II�����Թ���ͼ�̶���ˮԡ���ȡ�
��1����ˮԡ���ȶ���ֱ���þƾ��Ƽ��ȵ�ԭ����_______________________________��
��2���۲쵽_________________________����ʱ��������������NaOH��Һ����ȫ��Ӧ��
��3���������������Ҵ��Ľṹ�����õIJ�����_________________________________��
��4��Ϊ֤����������NaOH�Ҵ���Һ�з���������ȥ��Ӧ��������Ƶ�ʵ�鷽���У���Ҫ�������______________________������ķ�����_____________(��˵�������õ��Լ�����ʵ�������Ԥ�������ʵ������)��
���𰸡�������е�ͣ��������������ʧ �Թ�����Һ���úֲ� ������ס��˴Ź������� ���ɵ����� �����ɵ�������ͨ��ʢ��ˮ���Թܣ���ͨ��ʢ��KMnO4��Һ���Թܣ�KMnO4��Һ��ɫ(��ֱ��ͨ��������Ȼ�̼��Һ)
��������
���������������Ʒ�Ӧ�����Ҵ����廯�ƣ���Ӧ����ʽΪCH3CH2Br+NaOH![]() CH3CH2OH+NaBr��
CH3CH2OH+NaBr��
��1��������е�ͣ��������ӷ�����ˮԡ�����Ⱦ��ȣ��������������ʧ���ʴ�Ϊ������е�ͣ��������������ʧ��
��2�������鲻����ˮ����ʼ��Һ�ֲ㣬���ɵIJ����Ҵ����廯�ƶ�������ˮ������Һ�ֲ���ʧ��������������NaOH��Һ����ȫ��Ӧ���ʴ�Ϊ�Թ�����Һ���úֲ㣻
��3���Ҵ����ӽṹ����������ԭ�ӣ����ǵı�Ϊ3��2��1�����ú�����ס��˴Ź������ɼ�⣬�ʴ�Ϊ������ס��˴Ź������ף�
��4�����۷���ȡ����Ӧ������ȥ��Ӧ����Һ�ж������Br-�������ɵ��л��ﲻͬ�������鷢����ȥ��Ӧ������ϩ������Ӧ�������ɵ��л�����ϩ��������ϩ�ɸ�������ʹ����KMnO4��Һ����ˮ��ɫ��ԭ�������У����Բ���ϴ����װ�ã��۲쵽����KMnO4��Һ��ɫ�������ݲ�������ˮ��������Ȼ�̼��Һ��ɫ���ɣ�
�ʴ�Ϊ�������壻�����ɵ�������ͨ��ʢ��ˮ���Թܣ���ͨ��ʢ��KMnO4��Һ���Թܣ�KMnO4��Һ��ɫ����ֱ��ͨ��������Ȼ�̼��Һ����ˮ��ɫ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֹ��ɽ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ�������Ԫ�ؿ���ǿ�Ͻ��ǿ�ȡ�Ӳ�ȡ��ɺ����Լ����ԣ�������ǿ�����¼���ʴ���ܡ���ͼ�ǻ����������Ʊ����������Ҫ����ͼ��
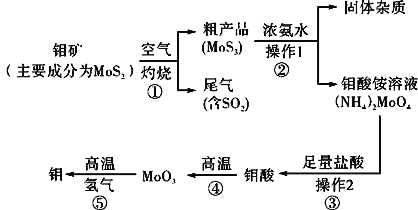
��1����Ӧ�ٵ�β�����������ã�д��Ӧ�ø�β���Ƶõ�������Ҫ��ѧ�Լ���___��
��2�������ʵ����ģ�����1�Ͳ���2������Ҫʹ�õ���Ҫ���������У�___��
��3�����ڿ��������������������⣬����������������������Һ���������ƣ��������ⲻ���������ϡ���ᡣ�����ƵĻ�ѧʽΪ___��
��4����ҵ���Ʊ���ԭ������CO��H2�ķ�Ӧԭ��ΪCO2��CH4![]() 2CO��2H2��CH4��H2O
2CO��2H2��CH4��H2O![]() CO��3H2���������������Ϊ80%��a L(��״��)��Ȼ��������������̼��ˮ�����Ļ�����ڸ����·�Ӧ������ת����Ϊ90%���ò����Ļ�ԭ������(CO��H2)��ԭMoO3���⣬�������������������Ϊ___��
CO��3H2���������������Ϊ80%��a L(��״��)��Ȼ��������������̼��ˮ�����Ļ�����ڸ����·�Ӧ������ת����Ϊ90%���ò����Ļ�ԭ������(CO��H2)��ԭMoO3���⣬�������������������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С���Ʊ��������(K2FeO4) ��̽�������ʡ�����: K2FeO4 Ϊ��ɫ���壬����KOH��Һ;����ǿ�����ԣ������Ի�������Һ�п��ٲ���O2,�ڼ�����Һ�н��ȶ����Ʊ�K2FeO4 (�г�װ����)
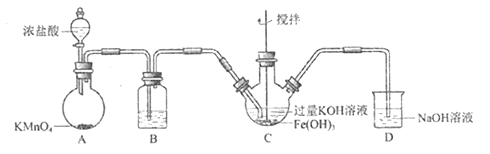
��1�����������װ�������Եķ�����________________________________________��
��2��AΪ��������װ�á�A�л�ѧ��Ӧ�ı���ԭ��Ԫ����____________________________��
��3��װ��B�������dz��ӣ������Լ�Ϊ_____________________________________��
��4��C�еõ���ɫ�������Һ����д��C�з����Ļ�ѧ��Ӧ���������ת�Ƶķ������Ŀ��_________�� �˷�Ӧ����:������Cl2______FeO42-(����>������<��)��
��5�� C�г��˷������еķ�Ӧ����������ѧ��Ӧ�����ӷ���ʽ��:______________________��
��6����KOH��Һ���ϴ��C�����ù��壬����KOH��Һ��K2FeO4�ܳ����õ���ɫ��Һa��ȡ����a,�μ����ᣬ��Cl2��������ʵ��ó�Cl2��FeO42-��������ǿ����ϵ���Ʊ�ʵ��ʱ�ó��Ľ����෴��ԭ����__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������м������ʣ��뽫����������пո��ڣ�
A��CH2=CH��COOH�����ᣨC17H33COOH��
B��12C60��ʯī
C��![]() ��
��![]()
D��35Cl��37Cl
E���Ҵ����Ҷ���
��1����Ϊͬλ�ص��� ��
��2����Ϊͬϵ����� ��
��3����Ϊͬ����������� ��
��4����Ϊͬ���칹����� ��
��5���Ȳ���ͬϵ��ֲ���ͬ�����壬Ҳ����ͬ�������壬���ɿ�����ͬһ�����ʵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H+��NH![]() ��Mg2+��Al3+��Fe3+��CO
��Mg2+��Al3+��Fe3+��CO![]() ��SO
��SO![]() ��NO
��NO![]() �еļ��֡���������п����������ɫ��ζ�����壻��������NaOH��Һ��������ɫ�������Ҳ����ij����������NaOH�����ʵ���֮��Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����( )
�еļ��֡���������п����������ɫ��ζ�����壻��������NaOH��Һ��������ɫ�������Ҳ����ij����������NaOH�����ʵ���֮��Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����( )
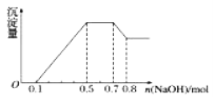
A.��Һ��һ������NH![]() B.��Һ��һ������Al3+
B.��Һ��һ������Al3+
C.��Һ��һ������NO![]() D.��Һ��һ������SO
D.��Һ��һ������SO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϡ�
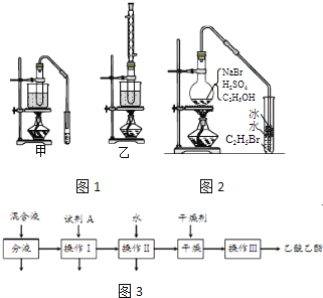
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���_____����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ���ס�������װ����ͼ1������ѡ�á�����������װ�õ�˵����ȷ����______����ѡ���ţ�

a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�����������Լ�A�Ļ�ѧʽ��______���������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ������λ����ͼ��ʾ����Zԭ�ӵ������������ǵ�һ���������3��������˵����ȷ���ǣ�������
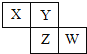
A.Z������������Ӧ��Y����
B.X��W��ԭ�Ӻ�����������9
C.X����������ǿ��Y����
D.����������Ӧˮ��������W��Zǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a g�������̷�ĩ����b mol/L��Ũ����c L�м�����ȫ�ܽ⣬��Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ������������ȷ����
A.�����ռ�������![]() L
L
B.NA�ɱ�ʾΪ��![]()
C.��Ӧ����Һ�е�Cl�D��ĿΪ��![]()
D.��Ӧ����Һ�е�H����ĿΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
I��CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
II��CO(g) + 2H2(g) ![]() CH3OH(g) ��H����129.0kJ��mol��1
CH3OH(g) ��H����129.0kJ��mol��1
��1��һ���¶��£����ݻ�2L�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�����ӦI��һ��ʱ���ﵽƽ�⡣
�� �� | �� | �� |
��Ӧ��Ͷ���� | 1molCH4��1molH2O | a molCH4��a molH2O��b molCO��c molH2 |
���ⶨ����������5min�ﵽƽ�⣬ƽ�����������ѹǿΪ��ʼ��1.2������Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���b��ȡֵ��ΧΪ__________��
��2����1.0molCH4��2.0molH2O(g)ͨ���ݻ�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ��
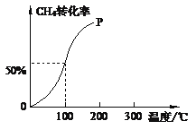
������100 ��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ______��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ____________��
��3�����ں��º�ѹ�����ڽ��з�ӦII��������˵���÷�Ӧ�ﵽƽ��״̬����________������ţ���
A����2��H��H�����ɵ�ͬʱ�� 3��C��H������
B��CO�ٷֺ������ֲ���
C�������л�������ѹǿ���ֲ���
D�������л��������ܶȱ��ֲ���
��4����ѹǿΪ0.1MPa���¶�Ϊ300�������£���amol CO��3amol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ����__________������ţ���
A��c(H2) ���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��n(CH3OH) ���� D��![]() ��С E��ƽ�ⳣ��K����
��С E��ƽ�ⳣ��K����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com