
已知在25 ℃、101 kPa下,1 g C8H18(l)燃烧生成CO2和液态H2O时放出48.40 kJ的热量,表示上述反应的热化学方程式正确的是
A.C8H18(l)+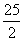 O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(l)+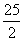 O2(g)===8CO2(g)+9H2O(l) ΔH=-5 517.6 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+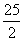 O2(g)===8CO2(g)+9H2O(g) ΔH=+5 517.6 kJ·mol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=+5 517.6 kJ·mol-1
D.2C8H18(l)+25O2(g)===16CO2(g)+18 H2O(l) ΔH=-5 517.6 kJ·mol-1
科目:高中化学 来源: 题型:
1 mol某烃A和1 mol苯完全燃烧,烃A比苯多消耗1 mol O2,若A分子结构中无支链或侧链,则:
(1)若A为环状化合物,它能与等物质的量的Br2发生加成反应,则A的结构简式为________________________________________________________________________;
(2)若A为链状烯烃,1 mol A最多可与2 mol Br2发生加成反应且A与等物质的量的Br2加成后的可能产物只有2种,则A的结构简式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO )>c(NH
)>c(NH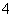 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中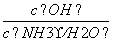 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10 mol·L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.KOH中含有离子键也含有共价键,属于离子化合物
B.HCl中存在离子键,属于离子化合物
C.含有共价键的化合物一定是共价化合物
D.阴、阳离子间通过静电引力而形成的化学键叫做离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇燃料电池(DMFC)可用于汽车、遥感通讯设备等,它的一极通入甲醇,一极通入氧气;电解质溶液是稀硫酸。电池工作时,甲醇被氧化为二氧化碳和水。下列叙述中不正确的是
A.负极的反应式为CH3OH+H2O-6e-===CO2↑+6H+
B.氧气在电极上的反应是O2+4H++4e-===2H2O
C.电池工作时,H+由正极移向负极
D.电池工作时,电子从通入甲醇的一极流出,经外电路流入通入氧气的一极
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com