
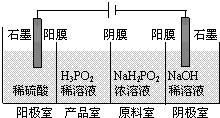


科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| B、已知2CO(g)+O2(g)?2CO2(g);△H=-akJ/mol,将2NA个CO与NA个O2混合充分反应放出akJ的热量 |
| C、用石灰乳完全吸收l mol Cl2时,转移电子的数目是NA |
| D、常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2HCO3-+2OH-→MgCO3↓+CO32-+2H2O |
| B、Mg2++2HCO3-+2OH-→MgCO3↓+2H2O |
| C、Mg2++2HCO3-+4OH-→Mg(OH)2+2CO32-+2H2O |
| D、HCO3-+OH-→CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
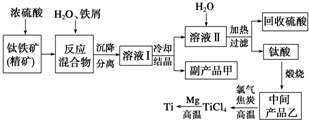 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如图:
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如图:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇和乙醛具有还原性 |
| B | 新生成的AgI浊液中滴入KCl溶液,震荡 | 有少量白色沉淀生成 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化形成致密的氧化膜 |
| D | 向包有Na2O2粉末的脱脂棉吹气或滴水 | 脱脂棉都会燃烧 | Na2O2与CO2或水的反应是放热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com