
| A. | 由硫酸铁溶液与硫酸铵溶液按一定比例混合后蒸发结晶而得 | |
| B. | 此溶液中与下列粒子可以大量共存:H+、SO42-、I-、C6H5OH | |
| C. | 此溶液中离子浓度大小关系为:SO42->Fe3+>H+>OH- | |
| D. | 将含0.1 molNH4Fe(SO4)2溶液中滴加0.1 molBa(OH)2,反应的离子方程式为:Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓ |
分析 A.需要由硫酸铁溶液与硫酸铵溶液按一定比例通过蒸发、浓缩、结晶获得;
B.铁铵矾溶液中含有铁离子,铁离子能够氧化碘离子;
C.铵根离子和铁离子部分水解,溶液显示酸性,则c(H+)>c(OH-)、c(SO42-)>c(Fe3+);
D.氢氧化钡不足,离子方程式按照氢氧化钡的化学式组成书写.
解答 解:A.直接蒸发结晶会导致NH4Fe(SO4)2•12H2O中的结晶水失去,应该采用浓缩、结晶的方法获得,故A错误;
B.铁铵矾溶液中含有铁离子,铁离子能够氧化I-,在溶液中不能大量共存,故B错误;
C.铵根离子和铁离子在溶液中部分水解,溶液显示酸性,则:c(H+)>c(OH-)、c(SO42-)>c(Fe3+),溶液中离子浓度大小为:c(SO42-)>c(Fe3+)>c(H+)>c(OH-),故C正确;
D.将含0.1 molNH4Fe(SO4)2溶液中滴加0.1 molBa(OH)2,铁离子结合氢氧根离子能力大于铵根离子,0.1mol铁离子完全反应消耗0.3mol氢氧根离子,0.2mol硫酸根离子完全反应消耗0.2mol硫酸钡,则则氢氧化钡不足,正确的离子方程式为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故D错误;
故选C.
点评 本题考查了离子共存、离子浓度大小比较、离子方程式的书写等知识,题目难度中等,注意掌握离子浓度大小比较方法,明确离子方程式的书写原则及离子共存的判断方法.


科目:高中化学 来源: 题型:选择题
| 改变的条件 | 正、逆反应速率变化 | 新平衡与原平衡比较 | |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | X的体积分数增大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定 量的Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
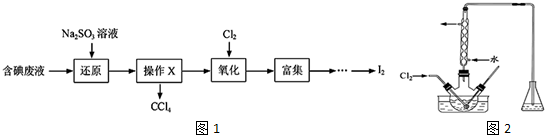
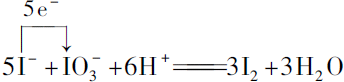 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
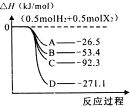 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b}{4}$mol | B. | $\frac{a+c}{4}$mol | C. | $\frac{3a+c}{4}$mol | D. | cmol或$\frac{b}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述实验说明Cl-与NH4+间有很强的结合力 | |
| C. | 所得溶液中形成了难电离的物质 | |
| D. | 上述过程中NH3•H2O的电离常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙炔 | C. | 丙烯 | D. | 丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com