
| A. | 在标准状况下,1mol O2 与1mol 纯碱的体积相同 | |
| B. | 常温常压下,18g H2O所含的氧原子的数目为NA | |
| C. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| D. | 1L 水溶解58.5g NaCl 所形成的溶液的物质的量浓度是0.1mol•L-1 |
分析 A.氧气为气体,纯碱为固体;
B.质量转化为物质的量,结合1个水分子含有1个氧原子解答;
C.锌与盐酸反应生成氯化锌和氢气,盐酸少量,依据盐酸的量计算转移电子数;
D.1L 水溶解58.5g NaCl,得到溶液体积大于1L.
解答 解:A.在标准状况下,1mol O2 体积远远大于1mol 纯碱的体积,故A错误;
B.常温常压下,18g H2O所含的氧原子的数目为$\frac{18g}{18g/mol}$×NA=NA,故B正确;
C.0.1mol Zn与含0.1mol HCl的盐酸充分反应,盐酸不足,生成0.05mol氢气,转移的电子数目为0.1NA,故C错误;
D.58.5g NaCl物质的量为1mol,溶于1L水,得到溶液体积大于1L,溶液浓度小于1mol/L,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用条件和对象,物质的量浓度中体积为溶液的体积是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
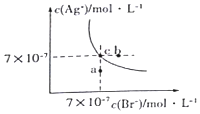 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 图中a点对应的是AgBr的不饱和溶液 | |
| B. | 在t°C时,AgBr的Ksp为 4.9×10-13 | |
| C. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| D. | 在t°C时,AgCl(s)+Br-(aq)?AgBr(s)+C1-(aq)的平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
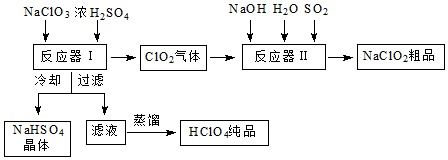
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁高温下与足量水蒸气充分反应转移电子数目为3NA | |
| B. | 100 g CaCO3和KHCO3混合固体中CO32-的数目为NA | |
| C. | 实验室用H2O2制备1mol O2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
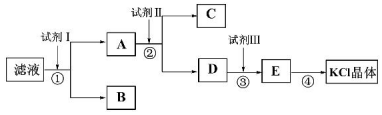
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| Ⅰ | 4.0 | 2.0 | 0 | 2.0 | 3滴 | 较快褪色 |
| Ⅱ | 4.0 | 4.0 | 0 | 0 | 3滴 | 缓慢褪色 |
| Ⅲ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
| Ⅳ | 4.0 | 0 | 2.0 | b | 3滴 | 较快褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
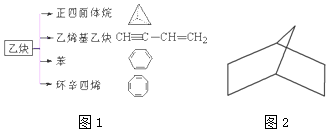
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com