
(6分)铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作________
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作________ _剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,生成 L SO2(标准状况)气体。
_剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,生成 L SO2(标准状况)气体。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
(6分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_________剂,具有 性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,生成 L SO2(标准状况)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为: (写出序号)
① 浓H2SO4 ②稀H2SO4 ③CuSO4
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省陆丰市碣石中学高一第四次月考化学试卷(带解析) 题型:填空题
(10分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓)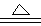 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性,氧化产物是 (写化学式)。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)Cu与SO2的还原性由强到弱的顺序为:Cu SO2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012年北京市高一上学期期中考试化学试卷 题型:填空题
(6分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生
反应;浓H2SO4作_________剂,具有
性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,生成
L SO2(标准状况)气体。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生
反应;浓H2SO4作_________剂,具有
性。在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,生成
L SO2(标准状况)气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com