
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |
分析 A、硫酸钡沉淀的生成也伴随有沉淀热的变化;
B、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水;
C、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水;
D、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水,C元素转化为CO2.
解答 解:A、H2SO4和Ba(OH)2反应过程中除了氢离子和氢氧根离子反应放热,硫酸钡沉淀的生成也伴随有沉淀热的变化,且H2SO4和Ba(OH)2反应的热化学方程式中两物质的计量数不明确,即H2SO4和Ba(OH)2反应的计量数不一定是1,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水,故CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol不是甲醇的燃烧热的热化学方程式,△H=-192.9 kJ/mol不是甲醇的燃烧热,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水,H2(g)的燃烧热△H=-285.8 kJ/mol,即H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,故有:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ/mol,故C错误;
D、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水,C元素转化为CO2,葡萄糖的燃烧热△H=-2800 kJ/mol,即1mol葡萄糖完全燃烧,H元素要转化为液态水,C元素转化为CO2时生成稳定的氧化物时放出的热量,故热化学方程式为$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol,故D正确.
故选D.
点评 本题考查了燃烧热、中和热的概念以及热化学方程的书写,应注意的是燃烧热是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,H元素要转化为液态水,C元素转化为CO2.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
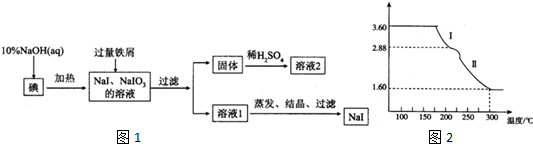
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 元素原子得电子能力:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | 仅② | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.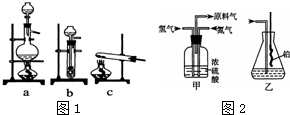
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a=2b | C. | a/2<b<a | D. | a>2b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ①和③ | C. | ②和③ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com