
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是 _________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________(填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____(填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s) ![]() Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l) ![]() H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________。(用含Ksp、Kw的代数式表示)
【答案】1:4 Zn(OH)2+2OH- =[Zn(OH)4]2- Cl- 、 NO3- C Fe3+(aq)+ 3H2O (l) ![]() Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol
Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol ![]()
【解析】
“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,由流程可知,先加NaOH可沉淀锌离子、铁离子,滤液C、D均含硝酸钠、氯化钠,沉淀A洗涤后得到沉淀B,加硫酸控制pH分离出Fe(OH)3,滤液E含ZnSO4,蒸发浓缩、冷却结晶、过滤分离出ZnSO4·7H2O。
(1)若硝酸被还原的产物为NH4NO3,金属锌全部生成硝酸锌,反应可以表达为:4Zn+10HNO3=4 Zn(NO3)2+NH4NO3+3H2O,被还原的硝酸得NH4NO3,有1mol,未被还原的在盐Zn(NO3)2和NH4NO3中,有9mol,氧化剂与还原剂的物质的量之比是1:4;
故答案为:1:4;
(2)Zn(OH)2溶解生成四羟基合锌酸钠,反应的离子方程式为Zn(OH)2+2OH-=[Zn(OH)4]2-,
故答案为:Zn(OH)2+2OH- =[Zn(OH)4]2- ;
(3)固体具有吸附性,沉淀A可吸附溶液中的Cl-、NO3-等离子,则滤液中应含有Cl-、NO3-,
故答案为:Cl-、NO3-;
(4)滤液E的pH=4,得到的沉淀为Fe(OH)3,Fe(OH)3的溶度积常数为Ksp=2.6×10-9×(10-10)3=2.6×10-39,
故答案为:C;
(5)已知:①Fe(OH)3 (s) ![]() Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O(l) ![]() H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
结合盖斯定律可知②×3-①可得:Fe3+发生水解反应的热化学方程式Fe3+(aq)+ 3H2O(l) ![]() Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol ;
Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol ;
(6)若Fe(OH)3的溶度积常数为Ksp,H2O的离子积常数为Kw ,根据(5)②×3-①可得:Fe3+(aq)+ 3H2O(l) ![]() Fe(OH)3 (s)+3 H+ (aq) Fe3+发生水解反应的平衡常数K=
Fe(OH)3 (s)+3 H+ (aq) Fe3+发生水解反应的平衡常数K=![]() ,
,
答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】铬铁矿的要紧成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
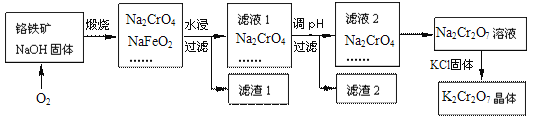
已知:①NaFeO2遇水强烈水解。
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
请回答:
(1)K2Cr2O7中Cr元素的化合价是___。
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是___。
(3)滤渣1为红褐色的固体,滤渣1的成分是(填名称)____,滤液1的成分除Na2CrO4、NaOH外,还含有___(填化学式)。
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是___。
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是___。
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、____、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl22CO2H2O。
回答下列问题:
(1)Cu在元素周期表中属于______(选填“s”、“p”、“d”或“ds”)区元素。研究人员发现在高温超导材料镧钡铜氧化物中含有Cu3+,基态Cu3+的电子排布式为______。
(2)C、N、O三种原子中的第一电离能最大的是______。NO3-离子的空间构型是______。
(3)CO与N2互称等电子体。
①它们的分子中都存在三个共价键,其中包含______个σ键,______个π键。
②下表为CO和N2的有关信息。
键的类型 | A-B(单键) | A=B(双键) | A≡B(叁键) | |
键能(kJ/mol) | CO | 351 | 803 | 1071 |
N2 | 159 | 418 | 946 | |
根据表中数据,说明CO比N2活泼的原因是______。
(4)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
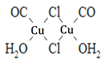
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
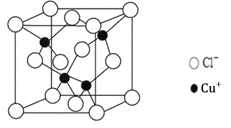
(5)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对CuCl晶体的X射线衍射图象分析,可以得出CuCl的晶胞如图所示,则距离每个Cu+最近的Cl-的个数为______。若晶体中Cl-呈立方面心最密堆积方式排列,Cl-的半径为a pm,晶体的密度为ρg/cm3,阿伏加德罗常数NA=______(列计算式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的描述中,正确的是 ______ ![]() 填序号
填序号![]() .
.
①为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
②化学药品着火,都要立即用水或泡沫灭火器灭火
③配制一定物质的量浓度的稀硫酸溶液时,量取浓硫酸后的量筒要用蒸馏水洗涤,并把洗涤液转入容量瓶中
④配制一定物质的量浓度的溶液定容时,俯视容量瓶的刻线,会使配制的浓度偏高
![]() 向溶液中加入盐酸酸化的
向溶液中加入盐酸酸化的![]() 溶液,产生白色沉淀,说明一定含有
溶液,产生白色沉淀,说明一定含有![]()
⑥检验红砖中的红色物质是否是![]() 的操作步骤为:样品
的操作步骤为:样品![]() 粉碎
粉碎![]() 加水溶解
加水溶解![]() 过滤
过滤![]() 向滤液中滴加KSCN溶液.
向滤液中滴加KSCN溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基自由基(·OH,电中性,O为-1价)是一种活性含氧微粒。常温下,利用·OH处理含苯酚废水,可将其转化为无毒的氧化物。
(1)·OH的电子式为________。
(2) pH=3时Fe2+催化H2O2的分解过程中产生·OH中间体,催化循环反应如下。将ii补充完整。
i.Fe2++ H2O2+H+ === Fe3++ H2O +·OH
ii.___ + ___ === ___ + O2↑+2H+
(3)已知:羟基自由基容易发生猝灭2·OH === H2O2。用H2O2分解产生的·OH脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如下图所示。0~20 min时,温度从40℃上升到50℃,反应速率基本不变的原因是________。


(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如上图所示。已知a极主要发生的反应是O2生成H2O2,然后在电解液中产生·OH并迅速与苯酚反应。
① b极连接电源的________极(填“正”或“负”)。
②a极的电极反应式为________。
③电解液中发生的主要反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解有关的是
①明矾可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③NH4Cl溶液可作焊接中的除锈剂
④实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞而不能用玻璃塞
A.①④B.②③C.③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4( )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
A. LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B. 1 mol LiAlH4在125℃完全分解,转移3 mol电子
C. LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+ 2H2O![]() LiAlO2+ 4H2↑
LiAlO2+ 4H2↑
D. LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.所有自发进行的化学反应都是放热反应
B.反应2A(g)+B(g)![]() 2C(g) ΔH<0在高温下能自发进行
2C(g) ΔH<0在高温下能自发进行
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com