
【题目】计算下列微粒中划“___”原子的孤电子对数。
(1)H2S________,
(2)PCl5_______,
(3)BF3___________,
(4)NH3__________。
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.第二次平衡时,Z的浓度为0.4 mol·L -1
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.m=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
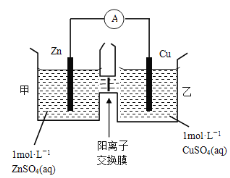
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是日常生活中用途广泛的金属。
I.(1)向NaAlO2溶液中滴加AlCl3溶液,生成白色胶状沉淀,则发生反应的离子方程式为_________________________。
(2)实验室常用还原性 Fe 粉与水蒸气反应的实验来研究 Fe 的还原性,则该反应的化学方程式为_________________________。
(3)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________。
II.已知合金A由两种常见金属组成。为测定其组成,某同学的实验流程如图所示:
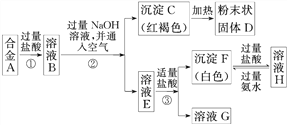
请回答:
(4)溶液E中所含的溶质是_________________(写化学式)
(5)合金A中的一种金属可以与粉末状固体D在高温下反应生成合金A中的另一种金属,请写出该反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲锌镉(Te-Zn-Cd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中不正确的是( )
A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔沸点
B.它易导电、导热,具有延展性
C.它的熔沸点比Zn的低
D.它的硬度和强度比Cd的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸HA溶液中![]() =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
A. 溶液中由水电离出的c(H+)=1×10-10mol·L-1
B. 溶液中存在HA![]() H++A-
H++A-
C. 与0.1 mol·L-1NaOH溶液等体积混合后所得溶液为中性
D. 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比为___________。
(2)2.5 mol Ba(OH)2中含有__________个OH-,2.5 mol Ba(OH)2的质量是___________g。
(3)在标准状况下,1.7 g氨气所占的体积约为___________L,它与标准状况_________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为_____________。
(5)同温同压下,SO2与氦气的密度之比为___________,若质量相同,两种气体的体积比为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天宫二号空间实脸室己于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于___________(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻瑞塞试剂瓶盛成KOH溶液,原因是____________(用离子方程式表示)。
(2)联氮(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,其电子式为________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力湃泉。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光认太阳能电池,该电池的核心材料是___________,其能量转化方式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、CO等大气污染物的测量及处理具有重要意义。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:________________。
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-905.5kJmol-1
4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)![]() 2NO(g)△H=+180kJmol-1
2NO(g)△H=+180kJmol-1
完成该方法中主要反应的热化学方程式
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=_________________。
4N2(g)+6H2O(g)△H=_________________。
②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是___________________。
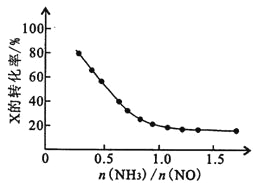
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如右图所示,则X是________________ (填化学式)。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是________________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
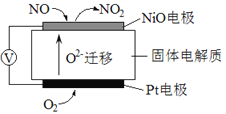
①Pt电极上发生的是______________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com