
【题目】25℃时,1molL﹣1的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH4+)分别为a、b、c(单位为molL﹣1),下列判断正确的是( )
A.a=b=c
B.a>b>c
C.a>c>b
D.c>a>b
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
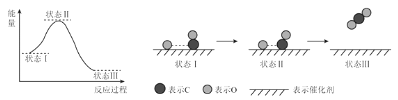
下列说法正确的是
A. 状态I→状态Ⅲ表示CO与O2反应生成CO2的过程
B. CO和O生成CO2是吸热反应
C. 状态I→状态Ⅲ表示CO与O反应生成CO2的过程
D. 在该过程中,CO断键形成C和O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是
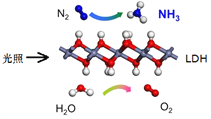
A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(s)反应的平衡常数与温度的关系如下:
温度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 则2min时c(A)=molL﹣1 , C的物质的量为mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有 a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃ 时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 .
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
Q | R | ||
T | W |
(1)R的原子结构示意图是 , 用化学方程式表示工业上常用于冶炼T单质的原理是 .
(2)元素的非金属性:QW(填“强于”或“弱于”),简述其原因是 .
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明酸性溶液中,能大量共存的离子组是( )
A. Na+﹑Ca2+﹑Cl-﹑CO32- B. Na+、Ca2+、HCO3-、NO3-
C. Cu2+﹑Cl-﹑Ca2+﹑NO3- D. NO3-﹑Na+﹑Ca2+﹑Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10﹣9 mol/L
B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7
C.在c(H+):c(OH﹣)=1:1012的溶液中,Na+、I﹣、NO ![]() 、SO42﹣能大量共存
、SO42﹣能大量共存
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO ![]() )+c(SO
)+c(SO ![]() )+c(HCO
)+c(HCO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组学生用图中所示装置(部分夹持装置略)探究NO与Na2O2反应的情况,提出假设并进行相关实验。

该研究性学习小组同学认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(1)在反应前,打开弹簧夹,通入一段时间N2,目的是__________________________。
(2)A 中反应的氧化剂与还原剂的物质的量之比为______________。
(3)B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
(4)C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
(5)F 中反应的离子方程式是_________________________________________。
(6)充分反应后,检验D装置中产物的方法是: _____________________________ ,则产物是NaNO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com