
合成氨反应N2(g)+3H2(g)
 2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
科目:高中化学 来源: 题型:
图像法是研究化学反应的焓变的一种常用方法。

图1
(1)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化曲线如图1所示,判断下列叙述中正确的是________。
A.每生成2 mol AB时吸收 b kJ 热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键时放出a kJ能量
(2)在微生物作用的条件下,NH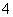 经过两步反应被氧化成NO
经过两步反应被氧化成NO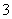 。两步反应的能量变化如图2所示:
。两步反应的能量变化如图2所示:
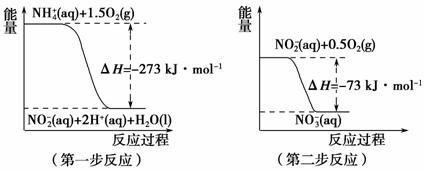
图2
1 mol NH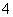 (aq)全部氧化成NO
(aq)全部氧化成NO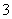 (aq)的热化学方程式是____________________________________________。
(aq)的热化学方程式是____________________________________________。
(3)图3中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素。
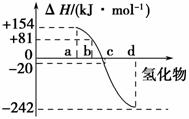
图3
①非金属元素氢化物的稳定性与氢化物生成热ΔH的关系为_______________________________________________________________。
②写出硒化氢发生分解反应的热化学方程式____________________________
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组设计了如图所示装置,调节滑动变阻器,在电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人高兴的现象。请帮助他们分析并回答下列问题(图中阳离子交换膜只允许阳离子和水分子通过):
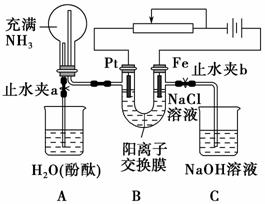
(1)写出B装置中的电极反应式:
Pt极_________________________________________________________;
Fe极____________________________________________________________。
(2)写出观察到的A装置中的现象:
①_________________________________________________________;
②__________________________________________________________;
③___________________________________________________________。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b,再观察C装置。若无现象,说明理由;若有现象,请写出有关反应方程式________________________________________________________________
_______________________________________________________________。
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
B.1.2 g C60和石墨的混合物中,含有的碳原子数目为0.1NA
C.2.24 L N2和NH3的混合气体中,含有的共用电子对数目为0.3NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L水中所含电子总数为NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO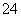 数目为0.6NA
数目为0.6NA
C.1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA
D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)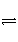
 CO2(g)+H2(g)在温度t1时达到平衡,[CO]1=[H2O]1=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为[CO]2和[H2O]2,平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,[CO]1=[H2O]1=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为[CO]2和[H2O]2,平衡常数为K2,则( )
A.若增大CO浓度,K2和K1都增大 B.K2>K1
C.[CO]2=[H2O]2 D.[CO]1>[CO]2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的检验方法正确的是 ( )。
A.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO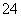
B.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
C.向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含有CO 或HCO
或HCO
D.将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L氦气中含有的电子数为2NA
B.11g的2H218O分子中含NA个中子
C.1molNH4+离子所含的质子总数为10NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com