
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4 B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li D.石墨>金刚石>SiO2>钠
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2016-2017学年湖南省益阳市高二下学期3月月考化学试卷(解析版) 题型:选择题
分别与H2完全加成,不能生成2,2,3—三甲基戊烷的是( )
A. 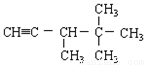 B.
B. 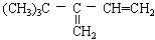
C. CH2=CHC(CH3)2CH(CH3)2 D. 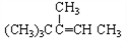
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
下列物质:①甲烷、②乙烯、③聚乙烯、④苯、⑤乙醇、⑥苯酚、⑦乙醛,即能使酸性高锰酸钾溶液褪色又能与溴水发生反应使之褪色的是
A. ②③⑥⑦ B. ②⑤⑥⑦ C. ②⑥⑦ D. ③⑥⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:填空题
铜、银、金与社会生活联系密切,请回答下列相关问题。
(1)在元素周期表中,铜、银、金元素位于同一族,它们基态原子的价层电子排布式中各能级上的电子数相等,各能层数依次增大,其通式为________(用n表示核外电子层数);铜元素所在周期中,基态原子未成对电子数最多的原子M 的价层电子轨道表达式为___________。
(2)乙醛是重要的化工原料,① CH3CH2OH 、CH3CHO的沸点分别为78.5℃、20.8℃,它们的相对分子质量相差2,而沸点相差比较大,其主要原因__________。
② 在H、C、N、O中,第一电离能最大的元素和电负性最大的元素组成的化合物的化学式为_____(填一种即可),CH4、NH3、H2O分子的键角从大到小的顺序为__________。
(3)金不溶于硝酸,但溶于“王水”,发生如下反应:Au + 4HCl+ HNO3 = H [ AuCl4]+NO + 2H2O,金溶于王水的主要原因是形成了[ AuCl4]-,提高了金的活泼性。在[ AuCl4]-中配位键的数目为______,写出该离子的结构式:_____________。
(4)金、银的一种合金具有较强的储氢能力。该合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点。该合金的化学式可以表示为__________。
(5)Cu(OH)2难溶于氢氧化钠溶液,但是易溶于浓氨水,用离子方程式表示其主要原因:____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形
C.若为A、B为同一主族元素,则AB3分子一定为三角锥形
D.若AB3分子为三角锥形,则AB3分子一定为NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
下列说法错误的是
A 冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的, 面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性, 形成氢键的三个相关原子可以不在条直线上
D.金属晶体的导电、导热性都与自由电子有关, 离子晶体在一定条件下可以导电
查看答案和解析>>
科目:高中化学 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:简答题
NO2与SO2能发生反应:NO2+SO2 SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g)  2NO2(g) △H=-113.0 kJ• mol-1
2NO2(g) △H=-113.0 kJ• mol-1
2SO2(g)+O2(g)  2SO3(g) △H=-196. 6 kJ• mol-1
2SO3(g) △H=-196. 6 kJ• mol-1
则NO2(g)+SO2(g)  SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
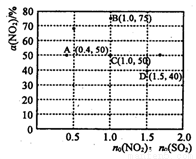
③若A点对应实验中,S02(g)的起始浓度为c0 mol•L-1 ,经过t min达到平衡状态,该时段化学反应速率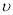 (N02)= _________mol•L-1•min -1.
(N02)= _________mol•L-1•min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
下列事实不能说明非金属性Cl﹥I的是( )
A. KClO3+I2=KIO3+Cl2 B. Cl2+2I-=2Cl-+I2
C. 酸性:HClO4﹥HIO4 D. 氧化性:Cl2﹥I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
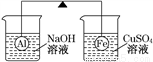
A. 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B. 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉
C. 反应后去掉两烧杯,杠杆仍平衡
D. 右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com