
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
分析 短周期元素,T元素原子M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,W单质既能跟酸反应,又能跟强碱反应,都产生H2,则W为Al元素,据此解答.
解答 解:短周期元素,T元素原子M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,W单质既能跟酸反应,又能跟强碱反应,都产生H2,则W为Al元素,
(1)X为C元素,C的一种同位素可测定文物年代,这种同位素的符号是614C,故答案为:614C;
(2)元素Y与氢元素形成一种离子YH4+为NH4+,故答案为:NH4+;
(3)根据元素周期律,同周期自左而右非金属性减弱,故Cl元素非金属性强于S,
①.物理性质不能说明非金属性强弱,故错误;
②.氢化物越稳定,中心元素的非金属性越强,故正确;
③.与氢氧化钠溶液反应不能说明非金属性强弱,如氧气不能与氢氧化钠溶液反应,非金属性O>S,故错误;
故答案为:Cl;②;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,Z的最高价氧化物的水化物为高氯酸,W的最高价氧化物的水化物为氢氧化铝,而反应的离子方程式为3H++Al(OH)3═Al3++3H2O,
故答案为:H2CO3;H2CO3为弱酸,其它三种为强酸;3H++Al(OH)3═Al3++3H2O.
点评 本题考查结构性质位置关系应用,难度不大,元素推断是解题的关键,难度中等,注意金属性、非金属性强弱比较实验事实,基础知识的理解掌握.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却后溶液仍澄清透明 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以与NaCHO3反应放出CO2 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 第三周元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
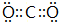 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com