

分析 除G外均为前20号元素,A原子基态时p能级原子轨道上电子数等于次外层电子数,则A的电子排布为1s22s22p2,即A为碳元素;
C元素的原子基态时s能级与p能级上的电子数相等,则C的电子排布为1s22s22p4,则C为氧元素;
A、B、C原子序数依次增大,则B为氮元素;
C、D有相同的能级,且D是同期中电负性最大的元素,则D为氟元素;
E原子的第一至第四电离能(kJ•mol-1)分别为:578、1817、2745、11575,即容易失去3个电子,则E为铝元素;
F元素原子中4s能级有2个电子,F的电子排布为1s22s22p63s22p64s2,则F为钙元素;
G元素的离子形成的硫酸盐结晶水合物呈蓝色,则G为铜元素,据此进行解答.
解答 解:由除G外均为前20号元素A原子基态时p能级原子轨道上电子数等于次外层电子数,则A的电子排布为1s22s22p2,即A为碳元素;C元素的原子基态时s能级与p能级上的电子数相等,则C的电子排布为1s22s22p4,则C为氧元素;
A、B、C原子序数依次增大,则B为氮元素;C、D有相同的能级,且D是同期中电负性最大的元素,则D为氟元素;
E原子的第一至第四电离能(kJ•mol-1)分别为:578、1817、2745、11575,即容易失去3个电子,则E为铝元素;
F元素原子中4s能级有2个电子,F的电子排布为1s22s22p63s22p64s2,则F为钙元素;G元素的离子形成的硫酸盐结晶水合物呈蓝色,则G为铜元素;
(1)B形成的单质为N2,N≡N中有2个π键、1个σ键,σ键和Π键的个数比为1:2;
氮气分子中的原子数为2,价电子数为10,而CO中的原子数为2,价电子数为4+6=10,则二者互为等电子体,
故答案为:1:2;CO;
(2)G为铜元素,原子序数为29,其基态电子排布为:1s22s22p63s22p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(3)因E为铝,B为氮元素,则常温下铝遇浓硝酸发生钝化,无明显现象,
故答案为:无明显现象(或钝化);
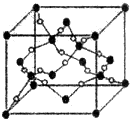
(4)①由图I可以看出晶体中与F离子最近且等距离的F离子数为:$\frac{3×8}{2}$=12;由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为:3+6+3=12,
故答案为:12;12;
②图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子;硼酸分子中含有3个氧氢键极性键和3个B-O极性键,所以B原子与极性键的个数比为1:6,
故答案为:O;
③CaF2为离子晶体,Cu为金属晶体,H3BO3为分子晶体,离子晶体的熔点高,金属晶体熔点大于分子晶体、小于离子晶体,即熔点由高到低的排列顺序为:CaF2>Cu>H3BO3;H3BO3晶体中存在的作用力除共价键以外,分子和分子之间存在分子间作用力,有因氧的电负性大,分子之间存在氢键,
故答案为:CaF2>Cu>H3BO3;分子间作用力、氢键.
点评 本题考查了位置、结构与性质关系的综合应用及晶胞的计算,题目难度中等,推断各元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,明确晶胞计算的方法.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH(OH)COOH | D. | CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
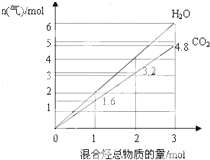 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 可能有乙烯 | B. | 一定有甲烷 | C. | 可能有丙烷 | D. | 一定没有丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钢铁的电化学腐蚀过程可用原电池或电解池的原理来解释 | |
| B. | 可将河道中的钢铁闸门与外加直流电源的负极相连以保护其不受腐蚀 | |
| C. | 在钢铁表面镀锌属于牺牲阳极阴极保护法 | |
| D. | 钢铁的电化学腐蚀中,主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.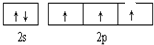 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com