
��2�֣����ף�P4�����������幹�͵ķ��ӣ��������������γ�P4O10ʱ��ÿ������ԭ��֮�����һ����ԭ�ӣ����⣬ÿ����ԭ������˫���ٽ��һ����ԭ�ӡ���ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡����ṩ���»�ѧ���ļ��ܣ�kJ/mol����P-P����198 kJ /mol ��P-O����360 kJ /mol ��O=O����498 kJ /mol ��P=O����585 kJ /mol���Ը�����Щ���ݣ���������·�Ӧ�ķ�Ӧ�ȣ�P4��S�����ף�+ 5O2��g��= P4O10��s����
��H= ��
 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ף�P4�����������������Σ�4��Pԭ��λ������������ĸ����㣬����ͼ��ʾ��
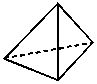
��1��������P�DP��֮��ļн���_________��
��2��1molP4�������__________molP�DP����
��3��P�DP����__________������Ǽ��ԡ����ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
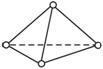
(1)������P��P��֮��ļн�Ϊ_____________��
(2)1 mol P4��������___________mol P��P����
(3)P4������___________ (ѡ����ԡ��Ǽ��ԡ�)���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
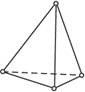
P��P��198 P��O��360 O=O��498 P=O��585
�Ը�����Щ���ݣ����㣺
P4�����ף�+5O2====P4O10���˷�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ��1 mol P4ȼ�շų������յ������Ƕ���ǧ��������ʾ�����������������͵ķ��ӣ��統�����γ�P4O10ʱ��ÿ������ԭ��֮�����һ����ԭ�ӣ����⣬ÿ����ԭ������˫�����һ����ԭ�ӣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ���������ԭ�Ӽ��γ�1mol��ѧ��ʱ�ͷŵ�������Ͽ�1mol��ѧ�������յ����������ṩ���»�ѧ���ļ��ܣ�kJ/mol��
P��P��198 P��O��360 O��O��498 P��O��585
�Ը�����Щ���ݣ��������·�Ӧ�ķ�Ӧ��Q��
P4�����ף�+5O2��P4O10��Q
 ����ʾ�����������������͵ķ��ӣ��������γ�P4O10ʱ��ÿ������ԭ��֮�����һ����ԭ�ӣ����⣬ÿ����ԭ������˫�����һ����ԭ�ӣ�
����ʾ�����������������͵ķ��ӣ��������γ�P4O10ʱ��ÿ������ԭ��֮�����һ����ԭ�ӣ����⣬ÿ����ԭ������˫�����һ����ԭ�ӣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ���������ԭ�Ӽ��γ�1mol��ѧ��ʱ�ͷŵ�������Ͽ�1mol��ѧ��ʱ�����յ����������ṩ���»�ѧ���ļ��ܣ�kJ/mol��P�DP��198 P�DO��360 O=O��498 P=O��585
�Ը�����Щ���ݣ��������·�Ӧ��Q
P4�����ף�(g) + 5O2(g) = P4O10(g)�� ��H=�DQ kJ/mol
����ʾ�����������������͵ķ��ӣ��������γ�P4O10ʱ��ÿ������ԭ��֮�����һ����ԭ�ӣ�����ÿ����ԭ������˫�����һ����ԭ�ӣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com