
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
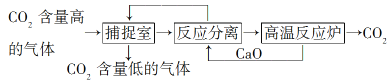
下列有关该方法的叙述中正确的是( )
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A. ①③ B. ②④ C. ③④ D. ①④
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
Ⅰ.直接作燃料
己知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为__________________________________。
Ⅱ. 生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
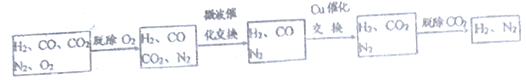
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+H2
CO2+H2
(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:________________________。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________________。
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1_________ɑ2 (填“>”、“<”或“=”);平衡常数K_______(填“增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________________________ 。
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:
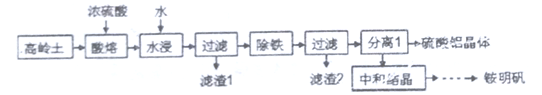
(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为________________________。
(7)检验“除铁”过程中铁是否除尽的方法是_________________________。
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够髙效低能耗地实现CO2的分离和捕获其原理如下图所示:
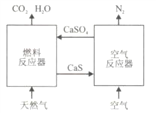
(1)已知在燃料反应器中发生如下反应:
i.CaSO4(g)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_____________(填“i”“ ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_____________ 0(填“>”“ =” 或“<”);720℃时反应ⅲ的平衡常数Kp=_________________。
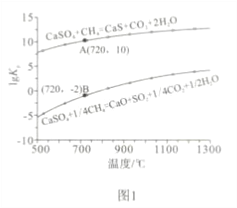

③下列措施可提高反应ii中甲烷平衡转化率的是______________ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃-900℃之间,从化学反应原理的角度说明原因:
________________________。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为 __________________(填“吸热”或“放热”) 反应。
(4)该原理总反应的热化学方程式为_____________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如右图所示,请回答:

25℃时向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对酸碱的认识,已有几百年的历史,经历了一个由浅到深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿伦尼乌斯(Arrhenius)提出的酸碱电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿伦尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。酸碱溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨电离的方程式(生成的两种微粒电子数相等):_________。
(2)1923年丹麦化学家布朗斯特和英国化学家劳莱提出了酸碱质子理论。凡能够给出质子(氢离子)的任何物质都是酸;凡能够接受质子(氢离子)的物质都是碱。按质子理论:下列微粒在水溶液既可看作酸又可看作碱的是________(填字母)。
A.H2O B.NH![]() C.OH- D.HCO
C.OH- D.HCO![]() E.CH3COO- F.Cl-
E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合形成化学键的物质是酸。如:
H+ + [∶OH]-―→ H∶OH
酸(电子对接受体) 碱(电子对给予体) 反应产物
试指出下列两个反应中的酸或碱:
①H3BO3+H2O![]() H++B(OH)
H++B(OH)![]() ,该反应中的碱是________(填“H3BO3”或“H2O”)。
,该反应中的碱是________(填“H3BO3”或“H2O”)。
②NaH+H2O===NaOH+H2↑,该反应中的酸是________(填“NaH”'或“H2O”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI:5I—+IO3—+3H2O==I2+6OH—
B. 向NH4HCO3溶液中加过量Ba(OH)2溶液并加热:NH4++OH—![]() NH3↑+H2O
NH3↑+H2O
C. 在海带灰的浸出液(含有I—)中滴加H2O2得到I2:2I—+H2O2+2H+==I2+2H2O
D. 用浓硝酸洗涤试管内壁的银镜Ag+2H++NO3—==Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况中,能通过置换反应得到铁的是( )
A.铜与氯化亚铁溶液常温下混合
B.一氧化碳通过灼热的三氧化二铁
C.氢气通入硫酸亚铁溶液
D.铝和四氧化三铁混合加热到高温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com