
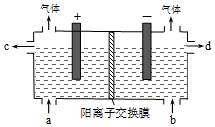
 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )| A. | 通电后阳极区溶液pH增大 | |
| B. | 阴极区的电极反应式为4OH--4e-=O2↑+2H2O | |
| C. | 当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成 | |
| D. | 通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 |
分析 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,在阳极附近产生的是氯气,发生反应:2Cl--2e-=Cl2↑,在阴极附近产生的是氢气,电极反应为:2H++2e-=H2↑,在阴极区域附近,锂离子移向阴极,碱性增强,产生LiOH.
解答 解:A、用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,在阳极附近产生的是氯气,发生反应:2Cl--2e-=Cl2↑,氯气溶于水显示酸性,溶液pH减小,故A错误;
B、在阴极附近产生的是氢气,电极反应为:2H2O-2e-=O2↑+2OH-,故B错误;
C、在阳极附近产生的是氯气,发生反应:2Cl--2e-=Cl2↑,电路中通过1mol电子的电量时,会有0.5mol的Cl2生成,故C错误;
D、在阴极区域附近,锂离子移向阴极,碱性增强,产生LiOH,LiOH浓溶液从d口导出,故D正确.
故选D.
点评 本题考查学生电解池的工作原理以及电极反应的书写知识,注意知识的归纳和梳理是解题的关键,难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
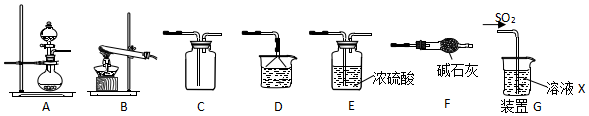
 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com