
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.③⑤⑥ B.③④⑥ C.④⑤⑥ D.①②④
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
由阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量有( )
A.1摩尔水的质量 B.1摩尔水蒸气的质量
C.1摩尔水的体积 D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写中,正确的是 ( )
A.向Fe2(SO4)3溶液中加入少量铁粉:Fe3++Fe===2Fe2+
B.向稀硫酸中滴入少量Na2CO3溶液:2H++CO ===CO2↑+H2O
===CO2↑+H2O
C.铜放入氯化铁溶液中: Fe3++Cu===Fe+Cu2+
D.氯化铁溶液与氨水反应:Fe3++3OH-===Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中错误的是( )
A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA
B.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1 NA
C.标准状况下,2.24 L Cl2分别与足量 Fe或Cu反应转移的电子数均约为0.2NA
D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体原子间的共用电子共6NA对
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列实验现象,所得结论错误的是( )
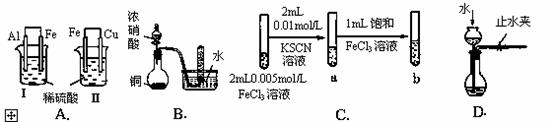
| 实验 | 实验现象 | 结论 |
| A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
| B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
| C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是( )
A.溶液中无法确定Al3+的存在与否 B.原溶液中不含的离子为:K+、Al3+、CO32-
C.步骤②中可以确定Fe2+、NO3-的存在 D.步骤③中共有2种钡盐沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
I.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
(3)研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
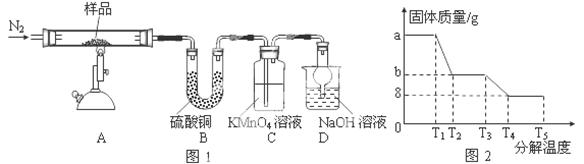
①装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
②实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
③从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式
。
④装置D球形干燥管的作用 。
⑤某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。
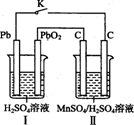 II.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为
II.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:
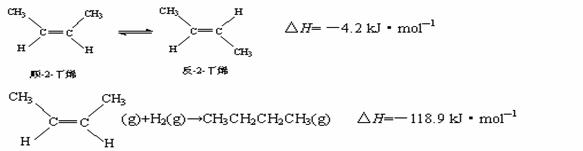
下列说法正确的是( )
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯氢化的热化学方程式为:
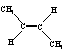 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-123.1 kJ·mol-1
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-123.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com