
)如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)

回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应: ;
(3)写出B管中发生的反应: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。
(1)①④
(2)2H++2e- H2↑、Mg2++2OH-
H2↑、Mg2++2OH- Mg(OH)2↓
Mg(OH)2↓
(3)4OH--4e- 2H2O+O2↑
2H2O+O2↑
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,木条复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
【解析】
试题分析:由装置图可知A为电解池的阴极,电极反应为:4H++4e- 2H2↑;B为电解池的阳极,电极反应为:4OH--4e-
2H2↑;B为电解池的阳极,电极反应为:4OH--4e- 2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应Mg2++2OH-
2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应Mg2++2OH- Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。在检验H2时利用其可燃性,检验O2时利用其能使带火星的木条复燃的性质进行检验。由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失。
Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。在检验H2时利用其可燃性,检验O2时利用其能使带火星的木条复燃的性质进行检验。由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失。
考点:原电池、电解


科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步(人教选修4)1.1.1化学反应与能量的变化(解析版) 题型:选择题
白磷与氧气可发生如下反应:P4+5O2 P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P
P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P O c kJ·mol-1、O
O c kJ·mol-1、O O d kJ·mol-1。
O d kJ·mol-1。
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:填空题
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。

(1)反应开始时反应速率加快的原因是 ;
(2)反应后期反应速率减慢的原因是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2 2NO,前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为( )
2NO,前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为( )
A.1.2 mol·L-1B.大于1.2 mol·L-1 C.小于1.2 mol·L-1D.不能确定
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:选择题
金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )
A.阳极发生还原反应,其电极反应:Ni2++2e- Ni
Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:填空题
)高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)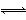 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:选择题
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
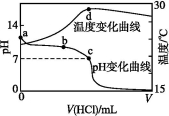
A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c( NH4)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(N)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2一次电池二次电池试卷(解析版) 题型:选择题
下面是两种常见的化学电源示意图,有关说法不正确的是( )

干电池示意图

铅蓄电池示意图
A.上述电池分别属于一次电池、二次电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.铅蓄电池负极材料为Pb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com