
分析 等物质的量的HA和NaOH恰好反应生成NaA,因为c(Na+)>c(A-),根据电荷守恒知c(H+)<c(OH-),溶液呈碱性,
(1)该溶液中A-水解但程度较小;
(2)任何电解质溶液中都存在电荷守恒,根据物料守恒计算c(HA)+c(A-);
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(4)25℃时,如果取0.2mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaA和HA,测得混合溶液的pH<7,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度;
(5)A.若反应后溶液呈中性,则溶液中存在c(H+)=c(OH-)=10-7 mol•L-1;
B.若V1=V2,要根据酸碱浓度相对大小确定溶液酸碱性;
C.若反应后溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.
解答 解:等物质的量的HA和NaOH恰好反应生成NaA,因为c(Na+)>c(A-),根据电荷守恒知c(H+)<c(OH-),溶液呈碱性,
(1)该溶液中A-水解但程度较小,所以存在c(HA)<c(A-),故答案为:<;
(2)任何电解质溶液中都存在电荷守恒,二者混合时溶液体积增大一倍,溶液浓度降为原来的一半,根据物料守恒得c(HA)+c(A-)=0.1 mol•L-1,故答案为:0.1 mol•L-1;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,该溶液中含有弱离子的盐,所以促进水电离,HA抑制水电离,则合溶液中由水电离出的c(OH-)>0.2mol•L-1 HA溶液中由水电离出的c(H+),故答案为:>;
(4)25℃时,如果取0.2mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaA和HA,测得混合溶液的pH<7,溶液呈酸性,说明酸的电离程度大于酸根离子水解程度,
故答案为:>;
(5)A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=2×10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,故正确;
B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,故错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故正确;
故选AD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,涉及盐类水解、弱电解质的电离,明确溶液中溶质及其性质是解本题关键,难点是(5)题酸碱体积判断,采用逆向思维方法分析解答,题目难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉浊液中通入过量的CO2 | |
| B. | 向带有氧化膜的铝片中加入盐酸 | |
| C. | 向含有1molCa(HCO3)2的溶液中加入1molNa2O2 | |
| D. | 向含有1molKAl(SO4)2的溶液中加入2molBa(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH${\;}_{4}^{+}$):c(NH3•H2O)比值增大 | B. | 所有离子浓度均减小 | ||
| C. | c(OH-):c(NH3•H2O)比值减小 | D. | 电离常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$、K+、Fe3+ | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 3%H2O2溶液中:Fe2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1的Na2SO3溶液中:K+、H+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
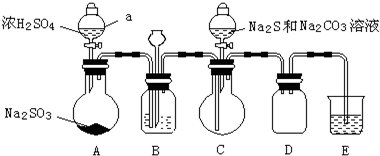
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 用FeCl3 溶液不能区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 1mol贝诺酯与足量NaOH 溶液共热最多可消耗5molNaOH钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com