
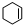
 )、环己二烯(
)、环己二烯( )和苯的氢化热数据.则下列说法正确的是( )
)和苯的氢化热数据.则下列说法正确的是( )| 化合物 |  +H2 +H2 |  +2H2 +2H2 | 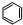 +3H2 +3H2 |
| 氢化热△H (kJ?mol-1) | -119.7 | -232.7 | -208.4 |
| A、环己二烯与H2的反应最剧烈 |
B、上述条件下,1 mol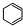 转变为 转变为 时放热113kJ 时放热113kJ |
| C、环己烯、环己二烯和苯有相同的官能团 |
| D、三种化合物中环己二烯的稳定性最强 |


科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、分液操作时,分液漏斗中下层液体及上层液体均从下口放出 |
| D、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a=b,则混合后溶液的pH<7 |
| B、若混合后溶液pH=7,则c(M+)>c(Cl-) |
| C、若a=2b,则c(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+) |
| D、若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4×10-7mol?L-1 |
| B、0.1×10-7mol?L-1 |
| C、4.2×10-8mol?L-1 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、SO42-、OH- |
| B、Ag+、NH3?H2O、NO3- |
| C、Ba2+、H+、NO3-、PO43- |
| D、Na+、Al3+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S) |
| B、某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| C、等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) |
| D、等PH值的①(NH4)2SO4溶液②NH4H SO4溶液③NH4Cl溶液中,c(NH4+)的大小关系:①=③>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com