
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:


物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
(3)仪器D中盛有冰水混合物,其作用为____________。
(4)操作1的名称为_______________。
(5)若省略步骤Ⅱ会导致的后果是________。
【答案】分液漏斗 CH3CH2OSO2OH+CH3CH2OH![]() H2SO4+CH3CH2OCH2CH3 使乙醚冷凝为液体以便收集 分液 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀
H2SO4+CH3CH2OCH2CH3 使乙醚冷凝为液体以便收集 分液 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀
【解析】
(1)仪器B为分液漏斗;
(2)已知总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,第一步反应为CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,第一步反应为CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,两式相减,可得第二步反应为CH3CH2OSO2OH+CH3CH2OH
CH3CH2OSO2OH+H2O,两式相减,可得第二步反应为CH3CH2OSO2OH+CH3CH2OH![]() H2SO4+CH3CH2OCH2CH3;
H2SO4+CH3CH2OCH2CH3;
(3)仪器D中盛有冰水混合物使乙醚冷凝为液体以便收集;
(4)通过操作1将溶液与乙醚分离,乙醚不溶于水,故为分液;操作2分离吸水后的氯化钙水合物固体与乙醚,为过滤;
(5)若省略步骤Ⅱ,乙醚粗品混有少量步骤I的 NaOH ,用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀。


科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
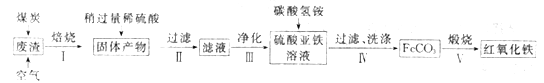
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:
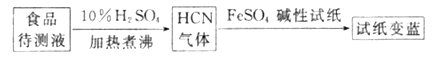
若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装量制取少量澳苯并证明该反应是取代反应。请回答:

(1)仪器A的名称为____________,冷凝水的进水口为_________,(填“m”或“n”)。
(2)制取溴苯的化学方程式为___________________。
(3)锥形瓶中足量NaOH溶液的作用是_________。
(4)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_________。
(5)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用__________(填仪器名称)分离出溴苯(仍含有少量苯)。
(6)设计实验证明制取溴苯的反应是取代反应___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的CH3NH2和1mol·L-1的NH2OH(NH2OH+H2O![]() NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法正确的是
NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法正确的是
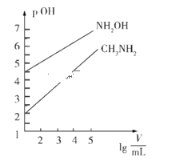
A. NH2OH的电离常数K的数量级为10-8
B. CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 当两溶液均稀释至lg![]() =4时,溶液中水的电离程度:NH2OH >CH3NH2
=4时,溶液中水的电离程度:NH2OH >CH3NH2
D. 浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:c(CH3NH3+)<c(NH3OH+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨态氮以NH3·H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO4·6H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3·H2O转化为MgNH4PO4·6H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO4·6H2O的生成。
Ⅱ.微波氧化法
(4)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10 min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由_____________
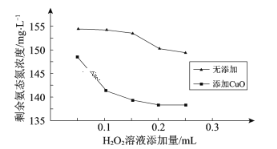
②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)3-甲基-戊烯的结构简式为___________
(2)某炔的分子式为C4H4它是合成橡胶的中间体,它有多种同分异构体。
①写出它的一种链式结构的同分异构体的结构简式(提示:同一个碳原子上连接2个碳碳双链的结构不稳定)______________
②它有一种同分异构体,每个碳原子均达饱和,且碳与碳的夹角相同,该分子中碳原子形成的空间构型为__________________形
(3)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2消耗氧气6.72L(标准状况下),则该物质的实验式是________
(4)写出由甲苯制TNT的方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A. 氢氧化钠与盐酸;氢氧化钠与醋酸
B. Na2CO3溶液与盐酸;CaCO3与盐酸
C. BaCl2溶液与Na2SO4溶液;BaCl2溶液与NaHSO4溶液
D. Fe(OH)3胶体的制备;Fe(OH)3沉淀的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铜 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是____________________________________。
(2)属于电解质的是__________________________________________。
(3)属于非电解质的是____________________________________。
(4)②在水溶液中的电离方程式为_____________________,①与②在溶液中反应使溶液呈中性的离子方程式为______________________________________________。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
I.还原产物是________。
II.当有2 mol HNO3参加反应时,被氧化的物质的质量为________g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。

下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com