
(2014?长宁区一模)①②③④甲种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④ B.①③④② C.③④②① D.③①②④
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:填空题
(9分)已知A(g)+B(g) 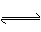 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)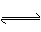 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:实验题
(16分)(2012?广东)碘在科研与生活中有重要作用,某兴趣小组用0.50mol?L﹣1KI、0.2%淀粉溶液、0.20mol?L﹣1K2S2O8、0.10mol?L﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82﹣+2I﹣=2SO42﹣+I2(慢) I2+2S2O32﹣=2I﹣+S4O62﹣ (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积V/ml | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= ml,理由是 .
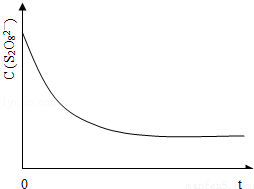
(3)已知某条件下,浓度c(S2O82﹣)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82﹣)~反应时间t的变化曲线示意图(进行相应的标注).
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2 (s)=2LiI(s)△H
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2 (g)=2I2 (s)+2Li2O(s)△H2
则电池反应的△H= ;碘电极作为该电池的 极.
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(山东卷解析版) 题型:选择题
(3分)(2012?山东)下列由相关实验现象所推出的结论正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO2﹣4
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:填空题
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按图所示步骤进行操作.
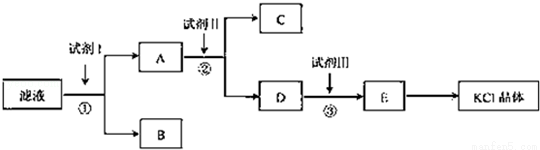
回答下列问题:
(1)起始滤液的pH 7(填“大于”、“小于”或“等于”),其原因是 .
(2)试剂I的化学式为 ,①中发生反应的离子方程式为 .
(3)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 ;
(4)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 ;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol?L﹣1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为 .(列式并计算结果)
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:选择题
下列关于化学键的叙述,正确的一项是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.伴有能量变化的物质变化都是化学变化 B.物质发生化学反应一定伴 随着能量变化
随着能量变化
C.吸热反应在常温下不能发生 D.放热反应的发生无需任何条件
查看答案和解析>>
科目:高中化学 来源:2012-2013陕西省富平县高一下学期期末考试化学试卷(解析版) 题型:填空题
有机化合物反应如下图,据此回答下列问题:
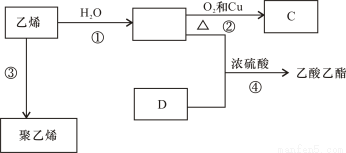
(1)乙烯的结构式为:。
(2)写出反应②③④的化学方程式:
②,反应类型:;
③,反应类型:;
④,反应类型:。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:
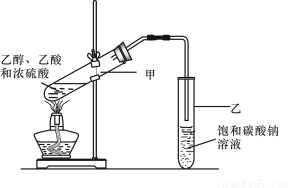
①浓硫酸的作用是。
②饱和碳酸钠溶液的主要作用是。
③若要把制得的乙酸乙酯分离出来,应采用的操作是。
④进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高一上学期期末化学试卷(解析版) 题型:选择题
下列物质属于电解质的一组是( )
A.CO2、NH3、HCl B.H2SO4、HNO3、BaCl2
C.H3PO4、H2O、Cu D.液态KNO3、NaOH溶液、C2H5OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com