
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
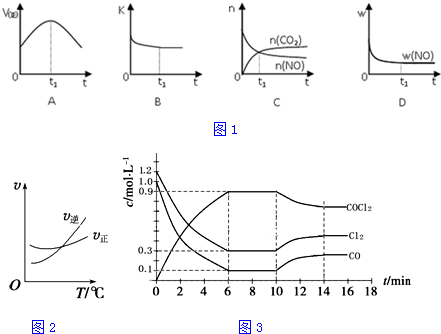
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 1000 | 1 | 2 | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
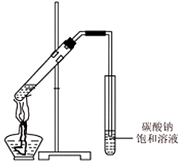 已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结 论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com