
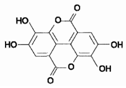
 紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.科目:高中化学 来源: 题型:实验题
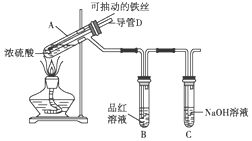 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-,K+,[Al(OH)4]-,OH- | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Mg2+,K+,Cl- | D. | NH4+,NO3-,CO32-,Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
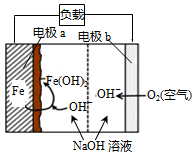 美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )
美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )| A. | a 极质量不变 | B. | b极为电池负极 | ||
| C. | 电子由a极经负载流向b极 | D. | 由电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
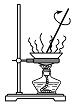 | 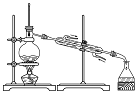 | 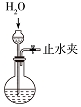 | 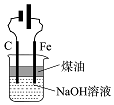 |
| A.蒸发氯化铝溶液的AlCl3 | B.分离乙酸钠和乙醇的混合液 | C.检查装置的气密性 | D.制备Fe(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 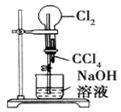 打开止水夹,挤压装置如图的胶头滴管使CCl4全部进入烧瓶 | |
| B. | 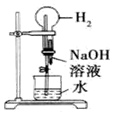 打开止水夹,挤压如图装置的胶头滴管使NaOH溶液全部进入烧瓶 | |
| C. | 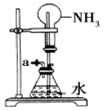 打开止水夹,用鼓气装置从如图装置的a处不断鼓入空气 | |
| D. |  打开止水夹,向如图装置的水槽中慢慢加入足量浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com