
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
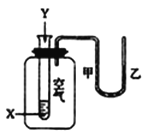
①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是( )
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 在同一反应中,用反应物或生成物浓度变化表示的化学反应速率的值是相等的
C. 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠与硫酸的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )
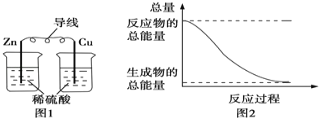
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用电子式表示氯化氢分子的形成过程:![]()
B. 二氧化硅熔点高于二氧化碳是因为其分子间作用力更大
C. 吸热反应一定要加热才能发生
D. 需要加热才能发生的反应不一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向火箭燃料液态联氨(N2H4)中加入催化剂,发生反应:N2H4(l)=N2(g)+2H2(g) △H。
已知: ①3N2H4(l)=4NH3(g)+ N2(g) △H1=-336.6kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g)△H2=-92.4kJ·mol-1。
2NH3(g)△H2=-92.4kJ·mol-1。
下列说法错误的是
A. 使用催化剂后,反应②的正、逆反应的活化能都减小,但△H1不变
B. △H=-151.8kJ·mol-1
C. 将28g N2和10mol H2混合充分反应,放出的热量一定小于92.4 kJ
D. 联氨作为火箭燃料是一种清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.2 g·mL-1,其中镁离子的质量分数为5.0%。300 mL该溶液中Cl-的物质的量约为( )
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使1.0体积的某气态烷烃和烯烃的混合气体在足量空气中完全燃烧,生成2.0体积的二氧化碳和2.2体积的水蒸气(均在120℃、1.01×105Pa条件下测定),则混合气体中烷烃和烯烃的体积比为
A. 2:3 B. 1:4 C. 4:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com