
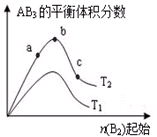
 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:分析 (1)根据反应物的浓度增大,反应速率增大判断;
(2)根据增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大判断;
(3)对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,生成物的物质的量增多;
(4)若T2<T1,由图象可知温度升高生成物的物质的量减小,说明升高温度平衡向逆反应分向移动,则正反应为放热反应.
解答 解:(1)根据图象可知,a、b、c各点中B2的起始物质的量依次增大,则反应物的浓度依次增大,反应速率依次增大,则a、b、c点反应速率大小a<b<c,故答案为:a<b<c;
(2)根据图象可知,a、b、c各点中B的起始物质的量依次增大,对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,则达到平衡时A2的转化率大小为:a<b<c,故答案为:a<b<c;
(3)对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,生成物的物质的量增多,所以达到平衡时,AB3的物质的量大小为c>b>a,故答案为:c>b>a;
(4)若T2<T1,由图象可知温度升高生成物的物质的量减小,说明升高温度平衡向逆反应分向移动,则正反应为放热反应,故答案为:放热.
点评 本题考查化学反应速率及化学平衡图象,明确横坐标为反应物B2的物质的量及该反应可能为吸热反应,也可能为放热反应是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水 | B. | 0.5mol/L盐酸 | C. | 0.5mol/LHAc溶液 | D. | 0.5mol/LKCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O-4e-=O2↑+4H+ | |
| B. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| C. | H3PO2溶于水的电离方程式为H3PO2?H++H3PO2- | |
| D. | H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-=PO23-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.酒曲捣碎 | B.酒曲发酵 | C.高温蒸馏 | D.泉水勾兑 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体压强不再改变 | |
| B. | N2和H2的物质的量不变且比例为1:3 | |
| C. | 断裂1mol N≡N键的同时,断裂3 mol H-H键 | |
| D. | 反应消耗N2、H2与产生NH3的速率之比1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
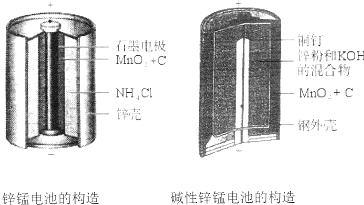
| A. | 该电池反应中二氧化锰起催化作用 | |
| B. | 电池负极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 当0.1molZn完全反应时,流经电池内部的电子个数为1.204×1023 | |
| D. | 碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com