

| A. | 在除去KCl的过程中必须用到过滤操作 | |
| B. | 在Cl2与KOH反应时,KOH作还原剂 | |
| C. | 在溶液A中加入KOH固体的作用是使KClO3转化为KClO | |
| D. | 在溶液A中加入KOH固体的作用是放出更多的热量,有利于提高反应速率 |
分析 足量Cl2通入KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下ClO-才能和Fe3+发生氧化还原反应生成FeO42-,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4,据此分析解答.
解答 解:A.由工艺流程可知,除去KCl即利用溶解度随温度的变化不同而除去,所以必须用到过滤操作,故A正确;
B.在Cl2与KOH反应时,Cl2既是氧化剂又是还原剂,故B错误;
C.由工艺流程可知,开始足量Cl2通入KOH溶液中反应,加KOH固体的目的是与过量的Cl2继续反应生成KClO,并且为氧化三价铁提供碱性环境,故C、D错误;
故选A.
点评 本题考查物质制备,涉及氧化还原反应、物质分离提纯、溶液配制等知识点,明确实验原理及物质性质、物质分离和提纯方法是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
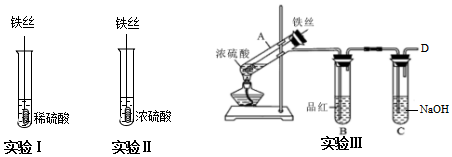
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
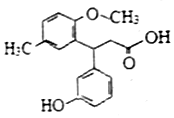
| A. | 所有碳原子可以共平面 | B. | 分子中有1个手性碳原子 | ||
| C. | 能与Na2CO3溶液反应 | D. | 能发生加成、取代、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是联系宏观和微观的物理量 | |
| B. | Na的摩尔质量为23g/mol | |
| C. | 非标准状况下气体摩尔体积不可能为22.4 L | |
| D. | 1mol氢的质量为2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com