

分析 (1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①计算;
(2)根据元素守恒和电子得失守恒写出化学方程式;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;X点CH4的平衡转
化率为80%,根据化学平衡常数K=$\frac{c{\;}^{2}(CO)c{\;}^{2}(H{\;}_{2})}{c(CO{\;}_{2})c(CH{\;}_{4})}$结合三组量代入计算;
(4)①由图可知,温度超过275~300℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;300~400℃时温度升高,化学反应速率加快;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,注意不能只增大甲烷的浓度,否则甲烷的转化率降低;
③写出醋酸电离平衡常数、醋酸根离子水解平衡常数,水的离子积常数进行比较,从而得出结论.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①得:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-73-171+41=-203kJ•mol-1,
故答案为:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-203kJ•mol-1;
(2)一定条件下向NH4HS溶液中通入空气,得到单质硫并再生出吸收液即氨水,则根据元素守恒及题中的反应物和生成物可知化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓,故答案为:2NH4HS+O2$\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
X点CH4的平衡转化率为80%,
则 CO2(g)+CH4(g)?2CO(g)+2H2(g),
开始0.1 0.1 0 0
转化0.08 0.08 0.16 0.16
平衡0.02 0.02 0.16 0.16
其平衡常数表达式是K=$\frac{c{\;}^{2}(CO)c{\;}^{2}(H{\;}_{2})}{c(CO{\;}_{2})c(CH{\;}_{4})}$=$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$,
故答案为:<;>;$\frac{0.16{\;}^{2}×0.16{\;}^{2}}{0.02×0.02}$;
(4)①温度超过275~300℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;300~400℃时温度升高,化学反应速率加快;
,故答案为:275~300℃时催化剂的催化效率降低,化学反应速率降低,300~400℃时温度升高,化学反应速率又加快;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,正反应是气体体积减小的反应,缩小容器体积增大压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强或增大CO2的浓度;
③电离方程式为HAc?H++Ac-,电离常数用Ka=$\frac{c(Ac{\;}^{-})c(H{\;}^{+})}{c(HAc)}$,乙酸根的水解方程式为Ac-+H2O?OH-+HAc,水解常数用Kh=$\frac{c(HAc)c(OH{\;}^{-})}{c(Ac{\;}^{-})}$,Kw=c(H+).c(OH-),所以Ka•Kh=Kw,则
Kh=$\frac{K{\;}_{w}}{K{\;}_{a}}$,故答案为:$\frac{K{\;}_{w}}{K{\;}_{a}}$.
点评 本题考查了盖斯定律的应用、方程式的书写、化学平衡常数、平衡移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

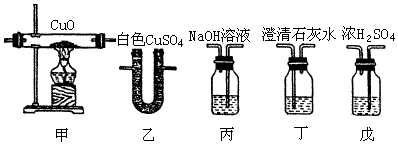
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠;②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加AgNO3溶液和稀硝酸 | 若溶液变浑浊,结合步骤2中的①,则假设一成立;结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
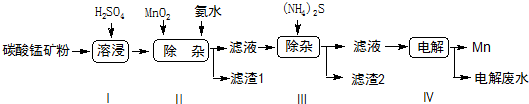
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com