

| A. | 铜是正极 | B. | 溶液中的Fe3+向铜棒移动 | ||
| C. | 电子从铜片经导线流向碳棒 | D. | 碳棒上有红色铜生成 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

 .A中反应的氧化剂和还原剂的物质的量之比为1:2.
.A中反应的氧化剂和还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
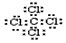 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和硝酸银用棕色试剂瓶保存 | |
| B. | 常温下铁和铂都不溶于浓硝酸 | |
| C. | 亚硫酸盐和硫酸亚铁固体长期暴露在空气中变质 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | NH3、CO、CS2都是极性分子 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:N>F>O | |
| D. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3、MgC12 | B. | NH4HCO3、AlC13 | C. | (NH4)2CO3、BaCl2 | D. | NH4HCO3、MgC12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com