
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
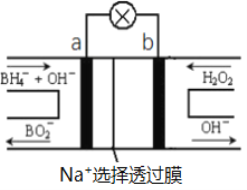
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移1mol电子,理论上有1molNa+透过选择透过膜
C. 电池放电时Na+从b极区移向a极区
D. 电极a发生还原反应
【答案】B
【解析】
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,a为负极,b为正极。结合原电池的工作原理和解答该题
A. 电解质溶液呈碱性,负极发生氧化反应生成BO2,电极反应式为BH4+8OH8e
=BO2+6H2O,故A错误;
B. 原电池中为钠离子选择透过性膜,只允许钠离子通过,每转移1mol电子,理论上有1molNa+透过选择透过膜,故B正确;
C. 原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故C错误;
D. 根据分析,a 为负极,发生氧化反应,故D错误;
答案选B。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室可以用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
①该反应的氧化剂是____,氧化产物是_____,还原产物是____。
②当有15.8gKMnO4参加反应时,被氧化的HCl有___mol,标况下生成Cl2的体积为____L,有____mol电子转移。
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是__。
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在__种原子,_种元素。
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
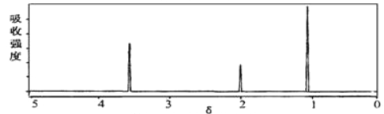
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
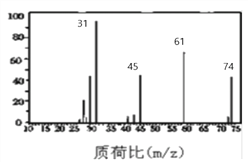
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
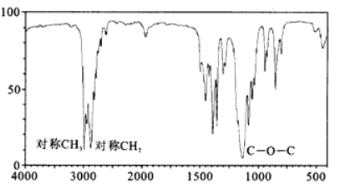
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.向Na2CO3溶液中逐滴加入盐酸,直到不再生成CO2气体为止,溶液中的![]() 浓度浓度变化是先变大后变小
浓度浓度变化是先变大后变小
B.向NaHCO3溶液中逐滴加入![]() 溶液,溶液中
溶液,溶液中![]() 浓度变化是先变大后变小
浓度变化是先变大后变小
C.向漂白粉溶液中通入CO2气体,沉淀质量先大后变小
D.向一定质量铁粉中逐滴加入CuSO4溶液,固体质量先变小后变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体G的合成路线如下:
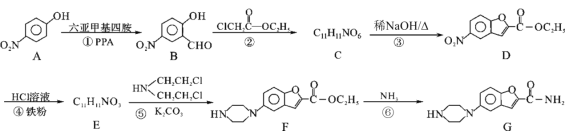
已知:![]()
请回答下列问题:
(1)A中含氧官能团的名称______________。
(2)反应④的反应类型是:______________。
(3)下列有关说法错误的是______________。
a.B遇FeCl3溶液显紫色且能发生银镜反应
b.A、B两种物质不可用核磁共振氢谱或红外光谱区别
c.C能发生取代、加成、氧化、还原反应
d.E能与NaOH反应,不能与盐酸反应
(4)写出E与NH(CH2CH2Cl)2反应得到F的化学方程式:____________________;⑤中加入K2CO3的作用是______________________________________________。
(5)B的同分异构体中,满足下列条件的有_____种;
①含有苯环;②能与NaOH溶液反应
写出其中一种核磁共振氢谱为三组峰的结构简式:________________________。
(6)已知: RBr ![]() RCN
RCN ![]() RCOOH,请以甲苯、乙醇等为原料制备
RCOOH,请以甲苯、乙醇等为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用加热高锰酸钾的方法制取少量氧气。
(1)现在欲制取标准状况下1.12L氧气,需要消耗高锰酸钾________g;
(2)反应产生的MnO2经分离出来,与足量浓盐酸反应,其中被氧化的HCl的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A. 2.7g B. 3.6g C. 5.04g D. 4.05g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com