
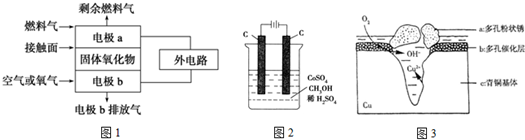
分析 (1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)①多孔电极a中燃料失电子发生氧化反应,O2-向负极移动;
②当燃料气为C2H4时,其正极发生还原反应、负极发生氧化反应;
(3)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;(4)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.05mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故B正确;
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故C错误;
故答案为:B;
(2)①多孔电极a中燃料失电子发生氧化反应,所以电极b,O2-向负极移动,故答案为:电极b;负;
②当燃料气为C2H4时,其正极发生还原反应电极反应为:3O2+12e-═6O2-;负极发生氧化反应,电极反应式为:C2H4+6O2--12e-═2CO2+2H2O,故答案为:3O2+12e-═6O2-;C2H4+6O2--12e-═2CO2+2H2O;
(3)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
(4)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;0.448.
点评 本题考查了燃料电池的工作原理以及电极反应式的书写等知识,属于综合知识的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Fe3+ | C. | Cl- | D. | Fe2+ | ||||
| E. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中燃烧会产生苍白色火焰 | |
| B. | 氯水用于漂白表现了HClO的强氧化性 | |
| C. | 漂白粉是混合物,其有效成分是氯化钙 | |
| D. | 漂白粉应密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| C. | 用水可区分苯和溴苯 | |
| D. | 结构如图( )的物质其一氯代物有4种 )的物质其一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
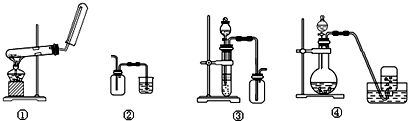
| A. | 装置①:用氯化铵和氢氧化钙制NH3 | B. | 装置②:收集NO气体 | ||
| C. | 装置③:用锌粒和稀硫酸制H2 | D. | 装置④:用双氧水和二氧化锰制O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | “塑料王”是高分子材料 | |
| B. | 二氟一氯甲烷的分子中只含共价键 | |
| C. | 聚四氟乙烯中碳原子均在同一直线上,形成链状高分子 | |
| D. | 四氟乙烯(CF2=CF2)中所有的原子都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
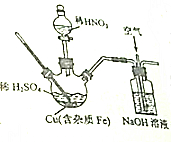 磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:
磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com