
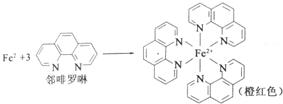
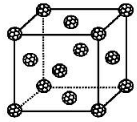
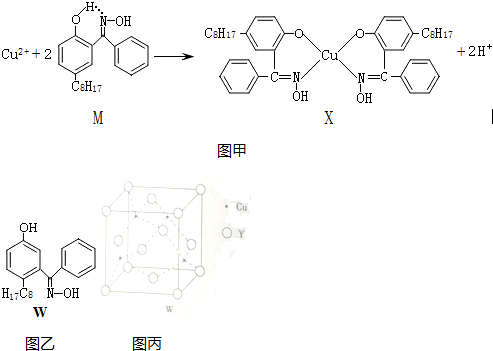
分析 (1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
②根据N、O原子价层电子对数,判断杂化方式;NH2OH中存在氢键,沸点较高;
③由结构可知,Fe2+与6个N原子之间形成配位键;
④计算Cl原子价层电子对数、孤对电子数,判断空间结构;
(2)Cu2+提供空轨道,N原子提供孤对电子,形成配位键,N、H原子之间以共价键结合,内界离子与外界离子以离子键结合;
(3)F的电负性比N大,N-F成键电子对向F偏移,不易提供孤电子对;
(4)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,属于分子晶体;
(5)根据均摊法计算晶胞中C60分子数目,第四周期电负性最小的原子为K,晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,晶胞中的8个顶点可以形成8个四面体空隙,即C60 晶体晶胞全部填满四面体空隙后可以容纳8个K原子,结合K、C60的数目之比确定化学式.
解答 解:(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时核外电子排布式为ls22s22p63s23p63d6;
故答案为:ls22s22p63s23p63d6;
②羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子;NH2OH分子之间存在氢键,沸点较高,
故答案为:N、O;NH2OH分子之间存在氢键;
③由结构可知,Fe2+与6个N原子之间形成配位键,故配位数为6,故答案为:6;
④ClO4-的中Cl原子价层电子对数为4+$\frac{7+1-2×4}{2}$=4、没有孤对电子,其空间结构为正四面体,故答案为:正四面体;
(2)Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,NH3分子中N、H原子之间以共价键结合,内界离子[Cu(NH3)4]2+与外界离子SO42-以离子键结合,
故答案为:离子键、共价键、配位键;
(3)F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,不易提供孤电子对,NF3不易与Cu2+形成配离子,
故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,NF3不易与Cu2+形成配离子;
(4)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体,
故答案为:分子;
(5)从图可以看出,晶胞中C60数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,晶胞有8个顶点,则可以形成8个四面体空隙,即可以填充8个K,则K、C60的数目之比=8:4=2:1,故填充K后所得化合物为K2C60,
故答案为:K2C60.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、氢键、空间构型、化学键、配合物、晶体类型与性质、晶胞计算等,综合考查物质结构主干知识,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 28 | B. | 30 | C. | 40 | D. | 42 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为293的117号元素原子中质子数比中子数多176 | |
| B. | 117号元素是非金属元素 | |
| C. | ${\;}_{20}^{48}$Ca、${\;}_{20}^{40}$Ca 互称同位素 | |
| D. | 预测${\;}_{117}^{293}$X、${\;}_{117}^{294}$X 性质相同(用X表示117号元素的符号) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 生成淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 将澄清石灰水滴入可能混有Na2CO3的NaHCO3溶液中 | 有白色沉淀产生 | 该溶液中一定含有Na2CO3 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入Na2SiO3溶液中 | 硅酸钠溶液产生白色胶状物质 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
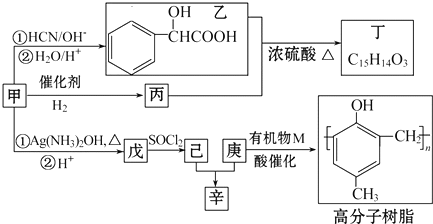

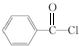 ,丁
,丁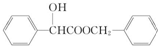 .
.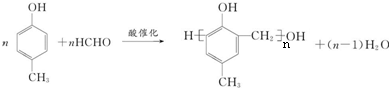 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g乙醇与足量的金属钠反应,可以放出0.25mol氢气 | |
| B. | 1mol乙醇充分燃烧生成2mol CO2和3mol H2O,消耗3mol O2 | |
| C. | 乙醇的沸点高于乙烷 | |
| D. | 1mol乙醇氧化后生成1mol乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com