
| A. | 易溶于水 | B. | 有较高的熔点 | C. | 熔化时能导电 | D. | 水溶液能导电 |
分析 含有离子键的化合物在熔融状态下能导电,只含共价键的化合物在熔融状态下不导电,要证明氧化铝中一定存在离子键,只要熔融状态氧化铝能导电即可,据此分析解答.
解答 解:A.氧化铝不溶于水,且不能根据是否易溶于水判断离子键,故A错误;
B.熔沸点的高低与离子键无关,如金刚石中只含共价键,但熔沸点较高,故B错误;
C.氧化铝熔融状态下能导电,说明熔融状态下电离出自由移动的阴阳离子,所以含有离子键,故C正确;
D.氧化铝不溶于水,其水溶液不导电,故D错误;
故选C.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确物质构成微粒是解本题关键,注意不能根据溶解性大小、熔沸点高低判断离子键,为易错题.


科目:高中化学 来源: 题型:解答题
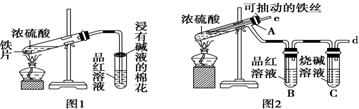
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.22mol | B. | 0.40mol | C. | 0.42mol | D. | 0.62mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
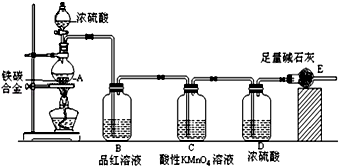
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾净化水 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用装有硅胶的透气小袋防潮 | |
| D. | 屠呦呦用乙醚从中药中萃取青蒿素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com