
| A、常温下,H2CO3分子不可能存在于pH=8的碱性溶液中 |
| B、在99mL的醋酸铵溶液中加入1mL pH=2的盐酸,所得溶液pH=4 |
| C、常温下,由醋酸铵溶液呈中性可推知NH4HCO3溶液pH<7 |
| D、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) |


科目:高中化学 来源: 题型:
A、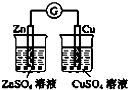 用如图装置验证化学能转化为电能 |
B、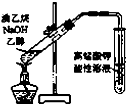 用如图所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
C、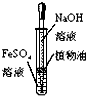 用如图装置制备氢氧化亚铁 |
D、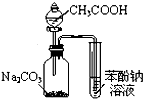 利用如图装置证明酸性:CH3COOH>H2CO3>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8 g |
| B、10 g |
| C、18 g |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸碱中和反应 |
| B、金属锌与硫酸铜溶液反应 |
| C、乙醇燃烧 |
| D、金属铜溶于氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中断键吸热,成键放热 |
| B、反应物的总能量高于生成物的总能量时发生吸热反应 |
| C、Ba(OH)2?8H2O与NH4Cl的反应是放热反应 |
| D、伴有能量变化的物质变化都是化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤⑥ | B、②⑥⑦⑧⑨ |
| C、①②⑥⑧ | D、②⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1mol分子中的化学键断时需要吸收能量/kJ | H2(g) | Br2(g) | HBr(g) |
| 436 | a | 369 |
| A、404 | B、260 |
| C、230 | D、200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键的键能由大到小:金刚石>碳化硅>硅>锗 |
| B、熔沸点由高到低:氯化钠>氧化铝>硅>二氧化碳 |
| C、硬度由大到小:C60>碳化硅>铁>氯化钠 |
| D、导电性能由强到弱:金>铜>石墨>二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com