
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
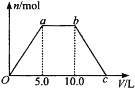
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
【答案】
(1)Ba2++CO2+2OH-==BaCO3↓+H2O
(2)CO2+2OH-==CO32-+H2O、CO32-+CO2+H2O==2HCO3-
(3)15.0;
(4)1∶1
【解析】
试题分析:(1)a点之前二氧化碳与氢氧化钡反应生成碳酸钡沉淀,反应的离子方程式为Ba2++CO2+2OH-==BaCO3↓+H2O,故答案为:Ba2++CO2+2OH-==BaCO3↓+H2O;
(2)a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,所以离子方程式为:CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-,故答案为:CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-;
(3)B~C之间发生反应:CaCO3+H2O+CO2═Ca(HCO3)2,由方程式可知生成碳酸钙沉淀与碳酸钙溶解消耗二氧化碳的体积相等,所以C点的体积为15,故答案为:15;
(4)消耗二氧化碳的量Ca(OH)2和NaOH的物质的量相等,然后根据相同条件下体积之比等于物质的量之比,A点之前发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,A~B之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,所以NaOH和Ca(OH)2的物质的量之比为1:1,故答案为:1:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.反应热△H不变
c.v正(H2) =v逆(CO) d.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:850℃时物质的浓度(mol/L)的变化
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:850℃时物质的浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c 2 | c 3 | c 3 |
4 | c 1 | c 2 | c 3 | c 3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①计算:3 min时CO的浓度 c 1 = mol/L,H2O (g)的转化率= 。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是 表中5min~6min之间数值发生变化, 可能的原因是
a .增加水蒸气 b.增加氢气浓度 c.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 某溶液可能含有Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() 、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO![]() 、NH
、NH![]() 一定存在,Cl-可能不存在
一定存在,Cl-可能不存在
D.CO![]() 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价) 11molP中被P氧化的P是_________mol.
(2)向含有1 mol FeCl2的溶液中通入0.2 mol Cl2,再加入含0.1 mol X2O![]() 的酸性溶液,使溶液中Fe2+全部恰好被氧化,并使X2O
的酸性溶液,使溶液中Fe2+全部恰好被氧化,并使X2O![]() 被还原为Xn+,则n值为________
被还原为Xn+,则n值为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纤维素为主要原料制备乙酸乙酯的路线如下:
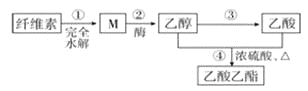
下列说法正确的是( )
A. 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯
B. M虽然分子结构中无醛基,但仍然可以发生银镜反应
C. 步骤②,1molM完全反应可以生成3mol乙醇
D. ③和④都发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国大力发展水力发电站建设,如葛洲坝,年发电量相当于每年燃烧3000万吨煤的火力发电站了出的电量,水力发电和火力发电相比,下列说法中正确的是( )
①减少CO2的排放有利于减轻温室效应②减少SO2的排放有利于减少降酸雨③减少废渣排放有利减少对土壤、水体污染④减轻白色污染
A.①②③④ B.①②③ C.①② D.①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )

A. I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B. “水”电池内Na+不断向负极作定向移动
C. 每转移1mole-,U型管中消耗0.5molH2O
D. “水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s时容器中N2的物质的量是( )
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s时容器中N2的物质的量是( )
A.1.6 mol B.2.8 mol
C.3.2 mol D.3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是: 在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目:___________________
当有0.2molKIO3与足量的KI反应时氧化剂与还原剂的物质的量之比是___ _____,转移的电子数目为 _ _ ___
(2)实验结束后分离I2和K2SO4溶液所用的方法是 ,所用的分离试剂是 ,所用的玻璃仪器有 .
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的稀硫酸溶液450mL,需量取98%的浓硫酸(其密度为1.84g/cm3)的体积为 ml,配制中需要用到的主要玻璃仪器有烧杯、玻璃棒、胶头滴管 .
(4)下面操作造成所配稀硫酸溶液浓度偏小的是_____________(填序号)
A.溶解的时候溶液没有冷却到室温就转移 |
B.转移时没有洗涤烧杯、玻璃棒 |
C.向容量瓶加水定容时眼睛俯视液面 |
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶 |
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com