
分析 (1)含有相同氧原子数的SO2和SO3,二氧化硫与三氧化硫的物质的量之比为3:2,依据m=nM计算解答;
(2)依据碳酸氢钠的不稳定性解答;
(3)①少量氢氧化钙溶液中加入足量的碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水;
②二氧化碳过量,二者反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:(1)含有相同氧原子数的SO2和SO3,二氧化硫与三氧化硫的物质的量之比为3:2,依据m=nM可知二者质量之比为:3×64:2×80=6:5;
故答案为:6:5;
(2)碳酸氢钠性质不稳定受热分解生成碳酸钠和水、二氧化碳,所以可以用加热方法除去碳酸钠中的碳酸氢钠;
故答案为:加热;
(3)①少量氢氧化钙溶液中加入足量的碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O;
故答案为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O;
②向偏铝酸钠溶液中通过量CO2,反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-.
点评 本题为综合题,考查了物质的除杂、物质的量有关计算、离子方程式的 书写,明确物质的性质及发生反应实质是解题关键,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应中为了提高正反应速率,及时抽走氨气 | |
| B. | SO2催化氧化中通入过量空气可提高SO2的平衡转化率 | |
| C. | 合成氨中加入催化剂可提高氮气的平衡转化率 | |
| D. | 合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯碱 | 冰水混合物 | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 乙醇 |
| C | 明矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | 氨水 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
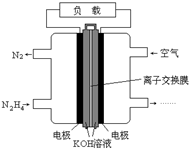 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为:N2H4-4e-=N2+4H+ | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池持续放电时.K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 | B. | NaOH | C. | FeCl2 | D. | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。(杂质发生的电极反应不必写出)请回答以下问题:
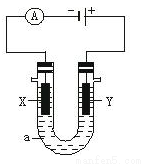
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式 。
②在X极附近观察到的现象是_______________________。检验Y电极反应产物的方法是________________。
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为 ;②Y电极的材料是_____________,主要电极反应式为_______________。CuSO4溶液的浓度 (填 “不变”“略有增加”或“略有减少”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
反应3CO + Fe2O3  2Fe + 3CO2可用于工业上炼铁,该反应属于
2Fe + 3CO2可用于工业上炼铁,该反应属于
A.置换反应 B.复分解反应 C. 化合反应 D.氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com