
 A��B��C��D��E��F��G��HΪ�������ڵĶ�����Ԫ�أ��䵥�ʵķе���ͼ��ʾ��
A��B��C��D��E��F��G��HΪ�������ڵĶ�����Ԫ�أ��䵥�ʵķе���ͼ��ʾ������ ������Ԫ�ص����У���ͼ��֪A�ķе�ܸߣ�B��C��D��E���ʵķе�С���㣬���ԭ��������֪����AΪ̼����BΪNԪ�ء�CΪOԪ�ء�FΪFԪ�ء�EΪNe����FΪNaԪ�ء�GΪMg��HΪAl���ݴ˽��
������Ԫ���У�ֻ��N��O����Ԫ���γɵĺ���ʮ�����ӵ��������к�����λ����
��ͬһ����Ԫ�أ�Ԫ�ص縺������ԭ���������������һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�
��HΪAlԪ�أ�H�ĵ縺��Ϊ1.5������Ԫ�صĵ縺��Ϊ3.0�����ߵ縺�Բ�Ϊ1.5��1.7�������γɵĻ����K��ˮ�⣬������������AlCl3Ϊ���ۻ����
��� �⣺������Ԫ���У�ֻ��N��O����Ԫ���γɵĺ���ʮ�����ӵ���������NH4+��H3O+�к�����λ�����ʴ�Ϊ��NH4+��H3O+��
��ͬһ����Ԫ�أ�Ԫ�ص縺������ԭ�������������������B��C��D����Ԫ�صĵ縺���ɴ�С��˳��ΪF��O��N��Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�����F��G��H����Ԫ�صĵ�һ�������ɴ�С��˳��ΪMg��Al��Na��
�ʴ�Ϊ��F��O��N��Mg��Al��Na��
��HΪAlԪ�أ�H�ĵ縺��Ϊ1.5������Ԫ�صĵ縺��Ϊ3.0�����ߵ縺�Բ�Ϊ1.5��1.7�������γɵĻ����K��ˮ�⣬������������AlCl3Ϊ���ۻ�����Ȼ�����Al��Clԭ��֮��ֻ���ڼ��Թ��ۼ���
�ʴ�Ϊ�����Թ��ۼ���
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��ؼ��Ǹ���ԭ�������뵥���۵��ƶ�Ԫ�أ��Ѷ��еȣ�ע���Ȼ���Ϊ���Ӿ�����������Ӿ��壬Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ձ��ڵ���Һת�Ƶ�����ƿ��ʱ�������ò��������� | |
| B�� | ��100mL��Ͳ��ȡ95.20 mL���� | |
| C�� | ��������ƽ��ȡ25.20gNaCl | |
| D�� | ��500mL����ƿ����50mL0.10mol/L��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al3+��Na+��NO3-��Cl- | B�� | K+��Na+��Cl-��NO3- | ||
| C�� | K+��Na+��Cl-��AlO2- | D�� | K+��NH4+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����C��ת����Ϊ75% | |
| B�� | ��Ӧ���ﵽƽ��ǰ������ʼ����V����V��������ʼ����V����V�� | |
| C�� | �ڸ������£���Ӧ2C��g��?A��g��+3B��g����ƽ�ⳣ��Ϊ2.7��1.54 | |
| D�� | ���е��Ȼ�ѧ����ʽΪ2C��g����?A��g��+3B��g����H=+Q2kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ڢ� | C�� | �٢ۢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
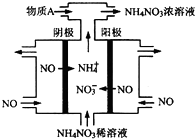 �����γɶ����������NO��NO2��N2O4�ȣ�
�����γɶ����������NO��NO2��N2O4�ȣ�| ʱ��/s | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��2 | B�� | 2��1 | C�� | 1��1 | D�� | ���Ƚ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com