
| A.微粒半径:F – < Cl – < Br – < I – | B.稳定性:HI< HBr <HCl< HF |
| C.沸点:HF< HCl < HBr< HI | D.阴离子还原性:F – < Cl – < Br – < I – |
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
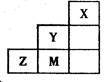
| A.Y、Z可形成ZY6分子 |
| B.X晶体属于原子晶体 |
| C.原子半径:Z > M > Y |
D.Z离子的结构示意图可表示为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.法国化学家拉瓦锡 | B.英国物理学家汤姆生 |
| C.意大利物理学家阿伏加德罗 | D.英国化学家道尔顿 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有②③⑤ | B.只有①②③ | C.除④、⑤外均正确 | D.全部正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 原子核外P亚层电子数比S亚层电子数多1 |
| C | 1molC单质能与冷 水反应,在标准状况下生成11.2LH2 水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
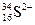 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
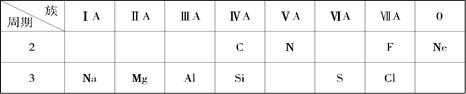

 ,呈两性的是 ;
,呈两性的是 ; 镁是制造汽车、飞机、
镁是制造汽车、飞机、 火箭的重要材料。写出工业上电解熔融
火箭的重要材料。写出工业上电解熔融查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 核外有5种不同能量的电子,其中有 2个未成对电子 2个未成对电子 |
| X | 最高化合价为+7价 |
| Y | 短周期主族元素原子中半径最大 |
| Z | 地壳中含量最多的金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大。其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物。
、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大。其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物。 ________,B、C、D、E元素第一电离能由大到小的顺序是____________(用元素符号表示);
________,B、C、D、E元素第一电离能由大到小的顺序是____________(用元素符号表示); 三元素形成的最简单分子中
三元素形成的最简单分子中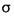 键与
键与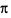 键个数比为______;
键个数比为______;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com