

| AlCl3 |
 -R+HX
-R+HX -R
-R| KMnO4 |
 -COOH
-COOH 再与C2H5Br发生取代反应生成
再与C2H5Br发生取代反应生成 -C2H5;根据信息③,
-C2H5;根据信息③, -C2H5在酸性高锰酸钾条件下氧化生成
-C2H5在酸性高锰酸钾条件下氧化生成 -COOH;再根据信息反应①,
-COOH;再根据信息反应①, -COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成
-COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成 ,据此书写各步反应方程式.
,据此书写各步反应方程式. 再与C2H5Br发生取代反应生成
再与C2H5Br发生取代反应生成 -C2H5;根据信息③,
-C2H5;根据信息③, -C2H5在酸性高锰酸钾条件下氧化生成
-C2H5在酸性高锰酸钾条件下氧化生成 -COOH;再根据信息反应①,
-COOH;再根据信息反应①, -COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成
-COOH再与浓硝酸在浓硫酸加热条件下发生硝化反应生成 ,各步反应方程式为:C2H5OH+NaBr
,各步反应方程式为:C2H5OH+NaBr| 硫酸 |
| △ |
 +C2H5Br
+C2H5Br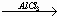
 -C2H5+HBr;
-C2H5+HBr; -C2H5
-C2H5
 -COOH+HBr;
-COOH+HBr; -COOH+HNO3
-COOH+HNO3
 +H2O;
+H2O;| 硫酸 |
| △ |
 +C2H5Br
+C2H5Br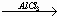
 -C2H5+HBr;
-C2H5+HBr; -C2H5
-C2H5
 -COOH+HBr;
-COOH+HBr; -COOH+HNO3
-COOH+HNO3
 +H2O;
+H2O;


科目:高中化学 来源: 题型:
| 3-n |
| 2 |

| n(OH-) |
| 3n(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、NO3-、K+、SO42- |
| B、CO32_、NO3-、HCO3-、Na+ |
| C、Na+、ClO-、AlO2-、NO3- |
| D、MnO4-、K+、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| Sb2O5 |
| H2 |
| Ni |
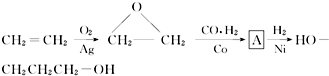
| 酶 |
| 酶 |
| ①H50Na |
| ②CH3Br |
| ①C2H5ONa |
| ②CH3CH2Br |
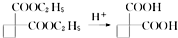 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.| 反应物 |
| 反应条件 |
| 反应物 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P的平均反应速率为0.15 mol/(L.min) |
| B、Q的转化率为25% |
| C、Q的平衡浓度为1mol/L |
| D、x的值是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
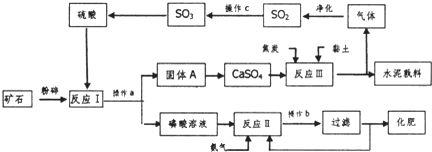
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| ||
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com