
【题目】
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。
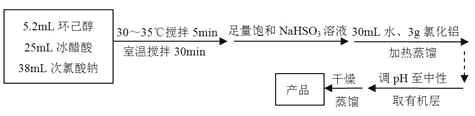
主反应:
回答下列问题:
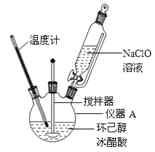
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
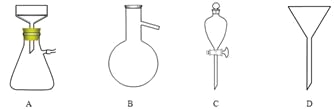
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
【答案】⑴三颈烧瓶(1分) ⑵ 搅拌器搅拌(1分);缓慢滴加NaClO溶液。(1分)
⑶ ClO-+ HSO3-="=" Cl-+ H++ SO42-(2分)用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量。(2分,其他合理答案也给分。)
⑷ BD (2分,每项1分,多答不得分)
⑸ 降低环己酮的溶解度,有利于环己酮分层 。(2分); C (1分)
⑹ 1.800mol/L (2分,有效数字不正确得1分,单位不写不得分)
【解析】试题分析:(1)根据仪器A的构造知其名称是三颈烧瓶;(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有搅拌器搅拌、缓慢滴加NaClO溶液;(3)饱和NaHSO3溶液和次氯酸钠溶液发生氧化还原反应生成硫酸钠和盐酸,离子方程式为ClO-+ HSO3-="=" Cl-+ H++ SO42-;加入的饱和NaHSO3溶液足量时溶液中无次氯酸钠,实验操作是用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量;(4)根据题意知,馏出液呈酸性,为将馏出液的pH调至中性,可以加入的试剂是无水碳酸钠和氢氧化钠固体,选BD;(5)调节pH后还需加入精制食盐,其目的是降低环己酮的溶解度,有利于环己酮分层,“取有机层”的基本操作是分液,使用的主要仪器是 分液漏斗,选C;(6)该实验的原理为:2H++ClO-+2I-![]() I2+Cl-+H2O、I2+2Na2S2O3==2NaI+Na2S4O6。次氯酸根和硫代硫酸钠的关系式为ClO-——2Na2S2O3,代入题给数据计算得该NaClO溶液的浓度是1.800mol/L。
I2+Cl-+H2O、I2+2Na2S2O3==2NaI+Na2S4O6。次氯酸根和硫代硫酸钠的关系式为ClO-——2Na2S2O3,代入题给数据计算得该NaClO溶液的浓度是1.800mol/L。


科目:高中化学 来源: 题型:
【题目】V、W、X、Y、Z是五种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:

已知Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成盐;Z是地壳中含量最多的元素;W原子的最外层电子数与Ne原子的最外层电子数相差1;V为原子核内有12个中子的二价金属,当2 .4克V与足量盐酸反应时,在标准状况下放出气体2.24L;请回答下列问题:
(1)指出Y元素在周期表中的位置_________。
(2)写出W的简单离子的结构示意图_______________。
(3)比较W的气态氢化物与H2S和HF的稳定性(由强到弱)____________。(填化学式)
(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,写出该化合物的电子式____________。
(5)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,则该物质含有的化学键类型为_____________。
(6)V与W两元素最高价氧化物的水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题
(1)实验室制取纯净氯气的实验中,除了二氧化锰、浓盐酸和浓硫酸,还需要___________、________(填写试剂或溶液名称)
(2)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式:____________________
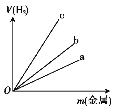
(3)图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是 (填“a”“b”或“c”)。
(4)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,该氢化物与足量盐酸反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。用0.200mol/L的盐酸标准液滴定待测液,滴定时用酚酞做指示剂。试根据实验回答下列问题:
(1)下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③⑤②①④ D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视_________,本实验滴定达到终点的标志是_________________________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 ,烧碱样品的纯度是___________
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
第三次 | 10.00 | 0.20 | 24.20 |
(4)若该实验修改成“用待测碱液滴定盐酸标准液”,则下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液。
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策。下列做法不应该提倡的是( )
A. 采取低碳、节俭的生活方式
B. 按照规定对生活废弃物进行分类放置
C. 深入农村和社区宣传环保知识
D. 经常用一次性筷子、纸杯、塑料袋等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某烃A的质谱和核磁共振氢谱如下两个图:

(1)A的结构简式___________________________。
(2)A的二氯代物种类数_____________________。
(3)请写出A的一氯代物消去的方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+(aq)+OH-(aq)=H2O(l) △H =a,则a可能等于
A. -57.3mol/L B. -57.3kJ/mol C. +57.3J/mol D. -57.3J/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com