


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、非标准状况下,1mol任何气体的体积不可能为22.4L |
| B、常温常压下,0.2mol Na2O2与足量H2O反应,转移电子的数目为0.2NA |
| C、标准状况下,NA个水分子所占的体积为22.4L |
| D、常温常压下,0.2mol Na2O2含有0.4mol阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
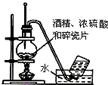 | 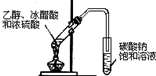 | 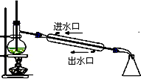 | 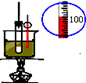 |
| A.实验室用乙醇制取乙烯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图所示,则:
M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图所示,则:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强(atm) | 4 | 6 | 10 | 20 |
| D的浓度(mol?L-1) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、③④ | C、④ | D、①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com