
Ge4++Fe2+![]() Fe3++Ge3+,Sn2++2Fe3+
Fe3++Ge3+,Sn2++2Fe3+![]() 2Fe2++Sn4+由此可确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
2Fe2++Sn4+由此可确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ge3+ B.Sn2+、Ge3+、Fe2+
C.Ge3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ge3+
科目:高中化学 来源:2012-2013学年福建省晋江市季延中学高二上学期期末考试化学试卷(带解析) 题型:填空题
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:
(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 , E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
查看答案和解析>>
科目:高中化学 来源:2014届福建省晋江市高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:
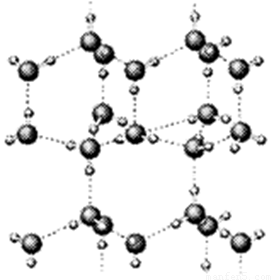
(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 , E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F—D |
F—F |
B—B |
F—B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g) 加热 FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为: 。
查看答案和解析>>
科目:高中化学 来源:2014届宁夏高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2===HCN+NaNO2, ②NaCN+HF===HCN+NaF,③NaNO2+HF===HNO2+NaF。
常温下,由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离平衡常数为4.9×10-10
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或
2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:
(1)右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 , E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g) 加热 FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com